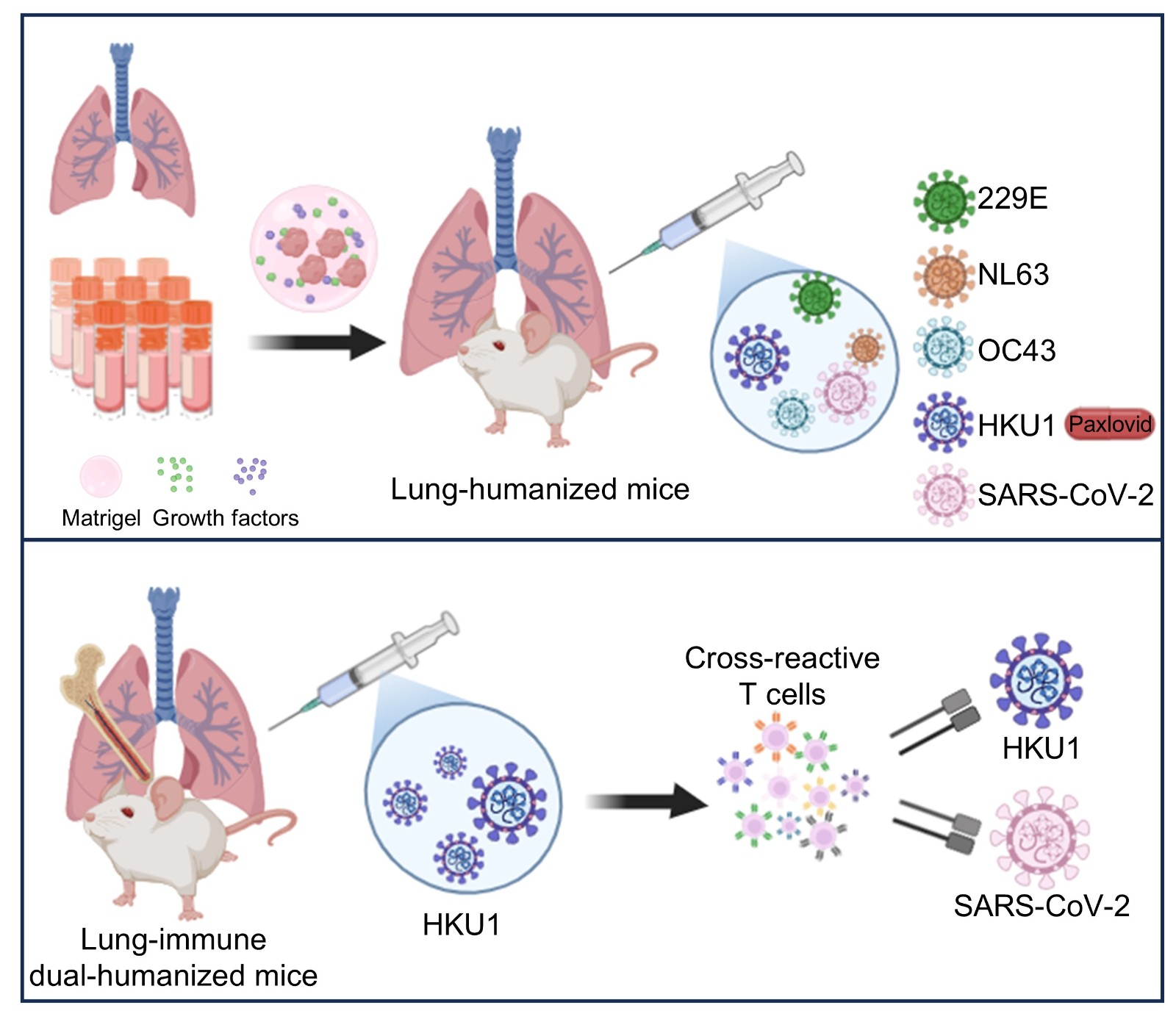
人源化小鼠模型是指在小鼠体内携带人类基因、细胞或组织,从而具备更接近人类生理环境与疾病特征的实验动物体系,已广泛应用于疾病机制研究、精准药物开发、临床诊疗优化和传染病防控等领域。其中,通过将人胎肺组织植入免疫缺陷小鼠体内构建的肺人源化小鼠,能够在体内重建人肺样结构,从而模拟人类呼吸道病毒感染,解决许多人源呼吸道病毒无法在传统小鼠体系中感染的难题。然而,该模型长期依赖新鲜人胎肺组织,不仅来源受限,也难以实现体系标准化和规模化应用,显著限制了其科研应用与临床前转化潜力。
21世纪以来,SARS、MERS以及COVID-19三次全球流行凸显了冠状病毒研究的重要性。除这些高致病性冠状病毒外,人低致病性冠状病毒(CCCoVs,包括229E、NL63、OC43和HKU1)在全球人群中普遍流行,多引起轻至中度呼吸道症状,并在致病性、组织嗜性及免疫反应等方面与高致病性冠状病毒存在显著差异,对理解冠状病毒演化、宿主适应和潜在免疫交叉具有重要意义。然而,受感染史复杂、临床样本获取困难以及病毒高度宿主特异性等限制,CCCoVs,尤其是HKU1的体内感染研究体系长期缺乏。
2025年12月7日,南京大学李颜课题组与广州医科大学赵金存课题组在 Advanced Science杂志以封面文章发表题为“A Lung-Immune Dual-Humanized Mouse Using Cryopreserved Tissue Enables Infection and Immune Profiling of Human Common Cold Coronaviruses”的研究论文。研究团队通过系统优化冻存人胎肺组织的移植策略,首次构建了能够稳定支持多种CCCoVs感染的肺-免疫系统双人源化小鼠模型,并解析了人肺组织的免疫微环境及其在病毒感染后的免疫应答特征。该成果不仅突破了HKU1体内感染模型长期缺失的瓶颈,也为呼吸道病毒感染、免疫机制研究及抗病毒药物评价提供了新的实验平台。

研究人员通过补充生长因子并系统评估冻存组织块大小与数量,显著提升了冻存人胎肺组织的重建效率,构建结构成熟、细胞组成完整的人肺样组织。在此基础上分别构建四种CCCoVs及SARS-CoV-2感染模型,并显示其在复制动力学、靶细胞谱与组织损伤方面均存在显著差异,同时在HKU1模型中验证Paxlovid的抗病毒效果。该体系为比较不同冠状病毒的致病机制及开展药物评估提供了可操作的体内研究框架。
在前述移植体系的基础上,研究人员通过联合移植人胎肺组织和造血干细胞,构建了新型的肺-免疫系统双人源化小鼠模型。流式与单细胞转录组测序结果显示,与鼠肺相比,人肺组织能够更有效支持人免疫细胞定植和成熟,显著富集人组织驻留记忆T细胞与人巨噬细胞,提示肺组织微环境对人免疫系统重建具有关键作用。值得注意的是,尽管大量未感染SARS-CoV-2的人群中可检测到针对其的反应性T细胞,但其来源一直缺乏直接实验证据。研究人员首次利用双人源化小鼠进行HKU1感染,发现可诱导病毒特异性T细胞应答并伴随低水平SARS-CoV-2交叉反应,为CCCoVs与SARS-CoV-2之间可能存在的免疫关联提供了直接证据。
南京大学博士研究生程春雨、广州医科大学孙静教授以及南京大学硕士研究生卢纯、余倩为论文的共同第一作者。南京大学李颜教授、广州医科大学赵金存教授以及南京鼓楼医院丁帅研究员为共同通讯作者。
图文来源:李颜实验室
责任编辑:张谨



