在胚胎和器官的发育过程中,不同组织之间必须在时间和空间上高度协调其生长(growth)与形态发生(morphogenesis)。尽管化学信号在发育调控中的作用已被广泛研究,但机械力是否以及如何作为“发育信号(developmental cues)”直接指导组织形态的建立,长期以来仍缺乏清晰的分子机制解释。
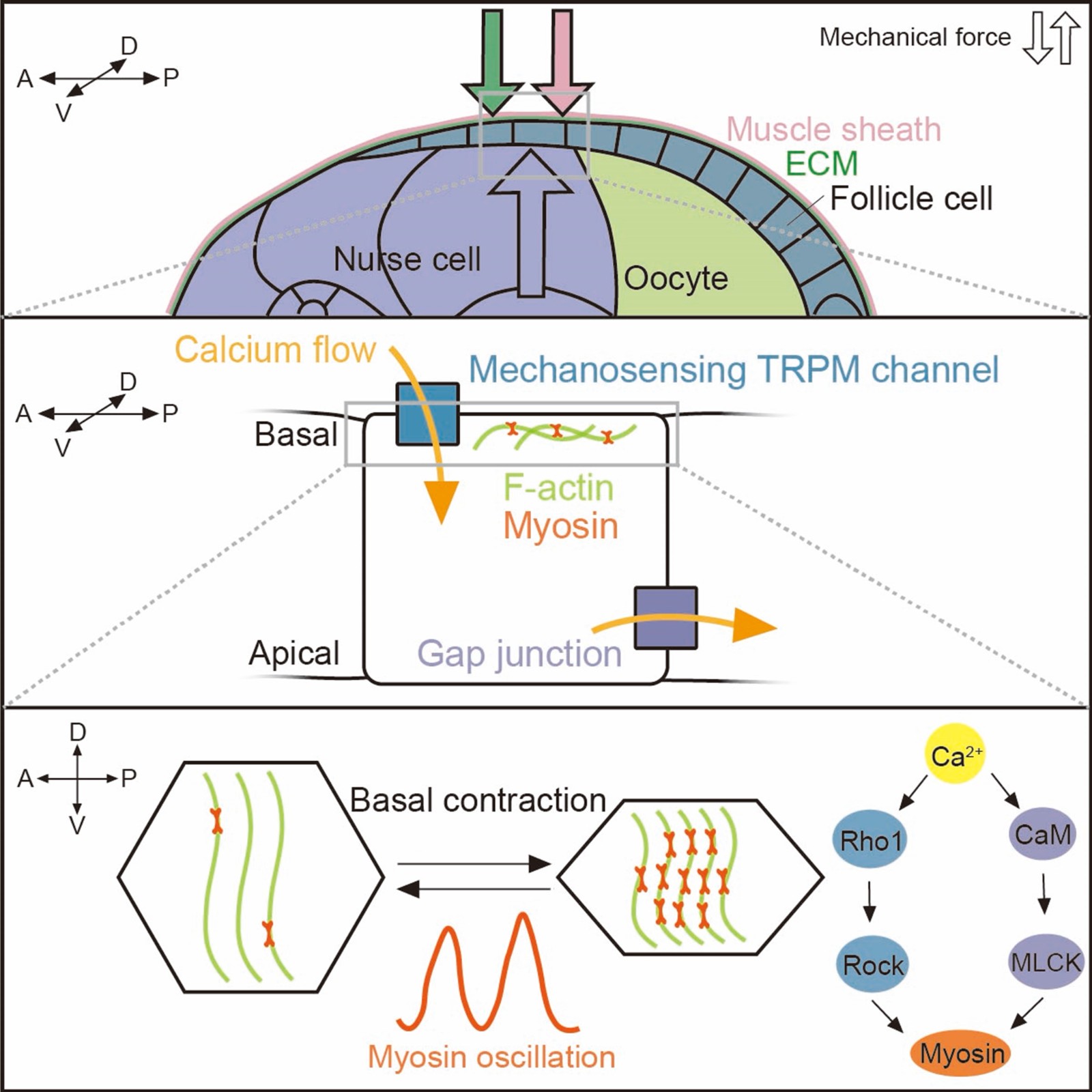
2025年 12月 1日,南京大学医学院模式动物研究所陈炯教授/王衡副研究员团队在《Current Biology》上发表了题为“TRPM-mediated mechanoreception regulates myosin oscillation during tissue elongation”的研究长文(article)。该研究以果蝇卵巢中的卵室(egg chamber)为模型,发现了由生殖系细胞快速生长所产生的“内在压力”可通过激活外层体细胞中的机械敏感钙通道TRPM来促进卵室的组织延伸;该过程引发钙离子内流,并通过 Rho1–Rok 和 CaM–MLCK 两条信号通路共同驱动肌球蛋白振荡,从而在空间与时间上精确协调组织生长和形态发生。

研究发现,在果蝇卵巢发育的特定阶段(第9期),快速生长的生殖系细胞会对外层体细胞系的上皮卵泡细胞产生显著的机械压力。这种“来自内部的压力”并非被动存在,而是作为一种发育信号,被体细胞中特异表达的机械敏感钙通道TRPM感知。TRPM通道的激活引发钙离子内流,并通过CaM-MLCK和Rho1-Rok两条信号通路协同调控肌球蛋白II的周期性装配与解离(myosin oscillation),从而驱动卵室沿前-后轴方向的定向延伸。
为精确解析机械力在这一过程中的作用,研究团队创新性地建立了可定量调控静水压力的活体成像体系,并结合遗传操作、药理干预和微流控压缩装置,对卵室所受内外力进行了系统操控。结果显示,无论是降低环境静水压力、削弱生殖系生长,还是破坏细胞外基质结构,均会显著抑制肌球蛋白振荡;相反,通过增强内部或外部机械压力,可以在不利条件下恢复这一关键动力学过程。
进一步研究表明,TRPM介导的钙信号不仅在单个细胞内发挥作用,还可通过间隙连接(gap junction)在上皮组织中形成钙波传播,从而实现组织尺度上的力学协同。该工作首次在体内系统阐明了“机械压力—TRPM感知—钙信号—肌球蛋白振荡—组织延伸”这一完整分子通路。该研究不仅加深了对器官形态建成基本原理的认识,也为理解机械信号在干细胞命运调控、组织工程和再生医学中的作用提供了重要理论基础。
最后,同期《Current Biology》邀请专家撰写了Dispatch 专文评论,充分肯定了该研究在发育生物学和力学生物学领域的原创性与前沿意义。Dispatch评论指出,该研究为“机械力作为主动发育信号”的观点提供了直接而有力的实验证据,展示了生长产生的压力如何在空间和时间上精确塑造组织形态,并强调该机制在理解多组织协同发育和自组织(self-organized)形态建立中的普遍意义。
南京大学医学院模式动物研究所陈炯教授与王衡副研究员为论文共同通讯作者,博士研究生董志翔与王衡副研究员为共同第一作者。此项工作也得到中科院生物物理所司光伟团队和浙江大学夏鹏团队的支持,并得到国家自然科学基金面上和青年等项目的资助。
原文链接:https://doi.org/10.1016/j.cub.2025.10.038
Dispatch评论链接:https://doi.org/10.1016/j.cub.2025.10.040
图文来源:陈炯实验室
责任编辑:张谨



