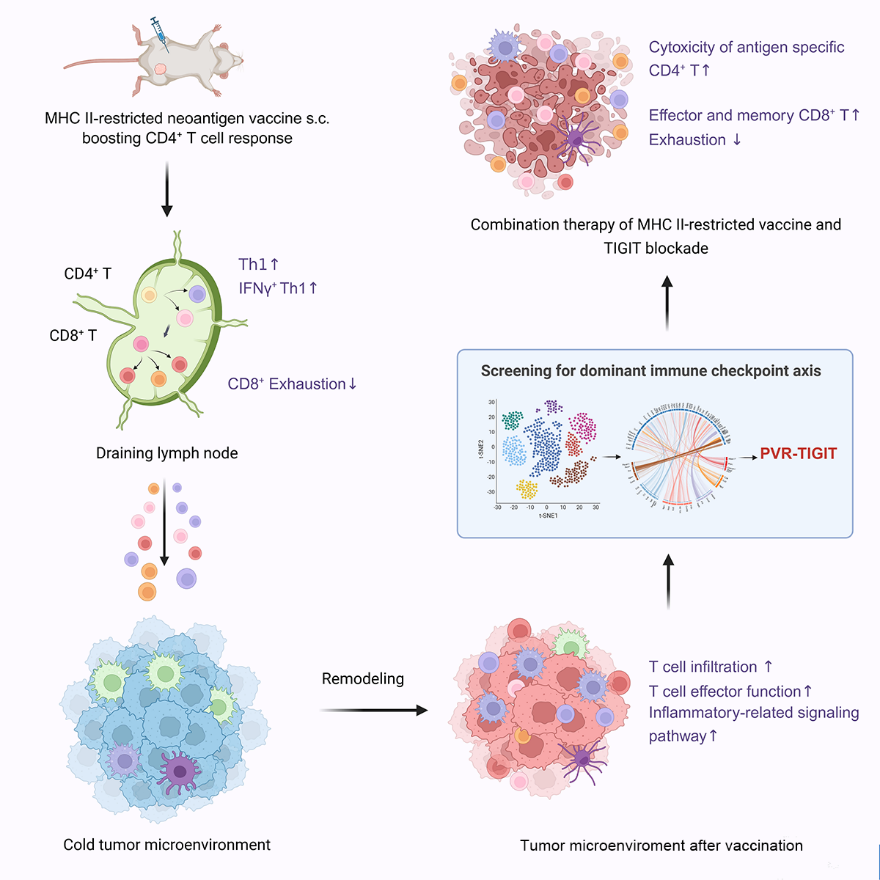
免疫治疗近年来取得显著进展,然而冷肿瘤因T细胞浸润缺失及高度抑制性免疫微环境,难以产生免疫响应。如何有效破除这一免疫负性状态,仍是当前冷肿瘤治疗领域亟待解决的核心难题。新抗原疫苗被视为激活肿瘤特异性T细胞的关键策略,但传统以MHC I类抗原为靶标、主要诱导CD8⁺ T细胞的疫苗往往面临免疫激活不足或耐受诱导等局限。随着研究的深入,MHC II类新抗原所诱导的CD4⁺ T细胞应答在抗肿瘤免疫中的重要作用日益凸显:不仅能够协助CD8⁺ T细胞发挥效应,更可通过调控肿瘤免疫微环境决定是否响应免疫应答。然而,靶向MHC II类新抗原疫苗仍处于发展早期,其对肿瘤免疫微环境的调控机制及与治疗潜力尚未明确。因此,深入阐明MHC II新抗原疫苗的免疫调控机制,并探索其在冷肿瘤治疗中的转化价值,具有重要的科学意义和临床紧迫性。
近日,南京大学医学院附属鼓楼医院肿瘤中心魏嘉教授、南京大学医学院模式动物研究所李颜教授团队在Med杂志上发表题为“MHC II-restricted neoantigen vaccine reverses immune microenvironment and overcomes resistance to immune checkpoint inhibitors in cold tumors”的研究论文,系统阐明MHC II 类新抗原疫苗可逆转冷肿瘤免疫微环境,并与 TIGIT 阻断治疗产生显著协同效应,实现对免疫耐药的深度突破。

MHC II类新抗原疫苗激活T细胞抗肿瘤免疫应答
研究人员首先针对B16F10冷肿瘤模型构建了MHC II类新抗原疫苗(M44肽+CpG佐剂),发现该疫苗可显著诱导引流淋巴结中CD4+ T细胞向Th1表型极化,并增强其IFNγ分泌能力。进一步研究发现,疫苗不仅提升了引流淋巴结中T细胞的活化水平,还显著增强了肿瘤内CD4+与CD8+ T细胞的浸润,部分模型中T细胞数量提升超过5倍。
疫苗重塑肿瘤免疫微环境,广泛激活髓系细胞亚群
通过单细胞转录组测序与Bulk RNA-seq分析,发现疫苗处理后,肿瘤微环境中抗原提呈分子、T细胞趋化因子及炎症信号通路显著上调。髓系细胞中,巨噬细胞向促炎表型极化,树突状细胞成熟与迁移能力增强,提示疫苗可以重塑肿瘤免疫微环境。值得注意的是,疫苗也诱导了PD-L1+未成熟中性粒细胞的扩增,提示其可能成为联合免疫检查点阻断的潜在靶点。
PVR-TIGIT轴成为疫苗诱导的关键抑制性信号通路
为进一步探索疫苗疗效受限机制,研究者通过CellPhoneDB与NicheNet分析发现,疫苗处理后PVR-TIGIT成为髓系细胞与T细胞之间最为显著增强的抑制性免疫检查点配受体对。实验证实,疫苗显著上调了T细胞上TIGIT及其配体PVR在髓系细胞上的表达,该信号通路可能通过抑制Th1与效应记忆CD8+ T细胞功能,限制疫苗疗效。
MHC II类新抗原疫苗联合TIGIT抗体展现协同抗肿瘤效果
在多种小鼠模型中,MHC II类新抗原疫苗与TIGIT抗体联用显著抑制了肿瘤生长,并使荷瘤小鼠生存期明显延长。该联合方案不仅提升了抗原特异性CD4+ T细胞的细胞因子分泌与杀伤能力,还促进了CD8+ T细胞向效应记忆表型分化,延缓其耗竭进程。此外,联合治疗显著降低了肿瘤微环境中PVR-TIGIT、CTLA4-CD80等抑制性信号通路的交互强度。
综上所述,本文将研究视角从传统的MHCI类新抗原拓展至II类新抗原,揭示了MHC II类新抗原疫苗在冷肿瘤治疗中激活T细胞应答、促进CD4+/CD8+T细胞浸润、重塑免疫微环境的独特优势。并进一步挖掘出该治疗过程伴随的关键免疫负调控机制—PVR-TIGIT信号通路富集。基于此,我们创新性地提出了“MHC II类新抗原疫苗+TIGIT阻断”的联合治疗新策略,为攻克冷肿瘤提供了新方向。
南京大学医学院附属鼓楼医院魏嘉教授、南京大学模式动物研究所李颜教授为本文通讯作者。南京大学医学院附属鼓楼医院宋雪如、施涛博士,南京大学模式动物研究所卢纯硕士为本文共同第一作者。
本文转载自微信公众号:BioArtMED,作者:BioArtMED



