慢性高血糖是2型糖尿病(T2D)及相关代谢紊乱的典型特征,可加剧胰岛素抵抗并损害骨骼肌葡萄糖利用,最终导致全身代谢功能障碍。骨骼肌约占人体重的40%,是人体最大的能量代谢和分泌器官,也是餐后葡萄糖吸收的主要部位,在维持全身葡萄糖稳态中发挥着关键作用。然而,高血糖如何引发骨骼肌代谢重塑的分子机制仍不清楚。
2025年7月24日,南京大学医学院模式动物研究所甘振继、付婷婷团队联合中国医科大学朴海龙团队在《Advanced Science》上合作发表了题为“Glucose-Responsive PAGR1-Regulated Skeletal Muscle Gene Program Controls Systemic Glucose Homeostasis and Hepatic Metabolism”的研究论文。该研究发现PAXIP1-associated glutamate-rich protein 1 (PAGR1) 是骨骼肌中一个关键的葡萄糖响应调控因子,其表达受高葡萄糖水平诱导,并系统性地调控全身葡萄糖稳态与肝脏代谢。

慢性高血糖是2型糖尿病(T2D)和其他代谢紊乱的标志,由于其导致葡萄糖毒性而带来重大挑战,葡萄糖毒性会加剧胰岛素抵抗并损害胰岛素分泌。长期暴露于高血糖水平与一系列并发症有关,包括微血管损伤,例如视网膜病变、神经病变和肾病,以及心血管疾病和非酒精性肝病。作为葡萄糖吸收和利用的主要部位,骨骼肌在维持全身葡萄糖稳态中起着核心作用。运动训练可以增强骨骼肌的葡萄糖吸收和利用能力,从而改善胰岛素依赖性和非胰岛素依赖性的葡萄糖吸收。这些适应性变化可以增强全身胰岛素敏感性,降低代谢综合征的风险,并减少肝脏脂肪堆积。相反,肌肉葡萄糖吸收和利用系统的缺陷,尤其是在慢性高血糖状态下,是胰岛素抵抗形成的关键。肌肉胰岛素抵抗的严重程度与高血糖水平密切相关,这表明存在一个会加剧代谢功能障碍的反馈回路。
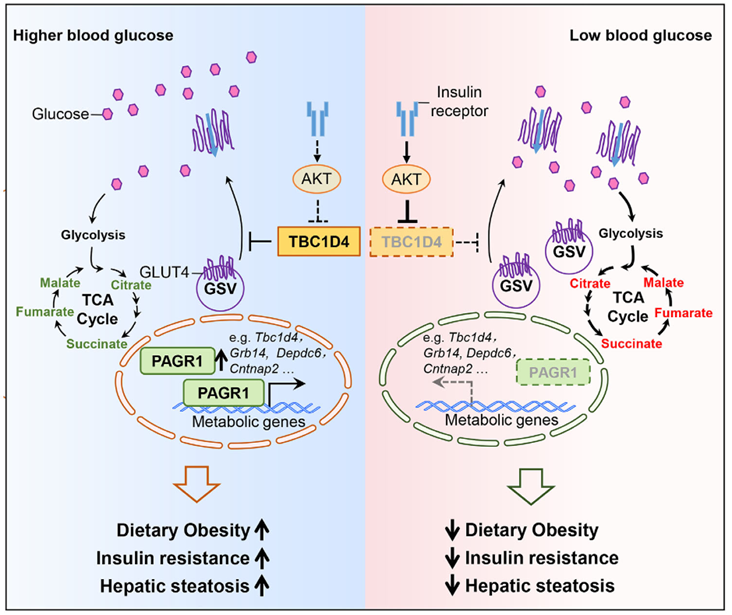
骨骼肌占胰岛素刺激葡萄糖吸收的60-80%,而胰岛素敏感葡萄糖转运蛋白4 (GLUT4) 介导了这一过程。胰岛素通过激活复杂的信号级联来刺激肌肉葡萄糖吸收,该信号级联包括胰岛素受体、胰岛素受体底物1 (IRS-1)、磷脂酰肌醇-3-激酶 (PI3K) 和AKT丝氨酸/苏氨酸激酶 (AKT)。该通路导致下游靶点(例如AS160(TBC1D4,TBC1结构域家族成员4))的磷酸化,从而调节Rab GTPase的活性,促进GLUT4向质膜移动。在胰岛素抵抗状态下,肌肉细胞通常表现出胰岛素刺激的GLUT4易位缺陷,导致葡萄糖摄取减少。即使整体GLUT4蛋白水平保持正常,这种缺陷也会出现,就像在2型糖尿病患者和某些啮齿动物模型中所见的那样。PI3K-AKT信号通路是控制骨骼肌葡萄糖摄取和代谢的已知途径,该通路的效率受多种调节蛋白和信号事件的调节。除了经典的胰岛素信号机制外,新兴证据表明骨骼肌细胞可以直接感知葡萄糖并触发激素非依赖性的AKT激活。这种葡萄糖传感通路与胰岛素协同作用,增强肌肉葡萄糖摄取并维持全身葡萄糖稳态。高血糖会导致骨骼肌葡萄糖转运系统下调和功能障碍。这种缺陷会损害葡萄糖转运和糖原合成,加剧胰岛素抵抗。胰岛素无法有效促进肌肉葡萄糖摄取会导致高血糖并进一步加剧葡萄糖毒性。然而,高血糖如何引发适应不良反应,导致肌肉葡萄糖利用受损和全身代谢功能障碍仍不清楚。
表观遗传调控对于基因-环境相互作用至关重要,并日益被认为是2型糖尿病(T2D)发病机制的关键因素。表观遗传修饰的动态特性使细胞能够对环境因素做出可逆反应,使其成为调控代谢变化中基因表达的关键机制。PAXIP1相关谷氨酸富集蛋白1(PAGR1),也称为PA1,最初被发现是MLL3/MLL4组蛋白H3K4甲基转移酶复合物中PTIP复合物的一部分。PAGR1参与多种生物学过程,包括胚胎发育、脂肪生成、DNA损伤反应、免疫球蛋白类别转换和癌症进展。然而,PAGR1在代谢调节中的作用,尤其是在骨骼肌中的作用仍不清楚。该研究探究了PAGR1在骨骼肌适应高血糖中的作用。研究发现PAGR1在骨骼肌中的表达响应葡萄糖的可用性,并调节肌肉葡萄糖利用途径。研究团队通过构建肌肉特异性PAGR1敲除小鼠模型,发现PAGR1缺失能够显著增强胰岛素信号通路,促进葡萄糖转运蛋白4(GLUT4)向细胞膜转位,从而提升骨骼肌的葡萄糖摄取与利用能力。机制研究表明,PAGR1能直接激活TBC1 Domain Family Member 4 (TBC1D4) 的表达,后者是一种已知负调控GLUT4转位的Rab GTP酶激活蛋白。重要的是,肌肉特异性敲除PAGR1能够有效预防高脂饮食诱导的胰岛素抵抗和肝脏脂肪变性。进一步的代谢组学与转录组学整合分析揭示,PAGR1通过协调PI3K-AKT信号通路及相关代谢基因程序,在骨骼肌内建立了一套葡萄糖响应性调控网络。这些发现确立了 PAGR1 作为肌肉葡萄糖感知和利用的关键介质的作用,使其成为旨在减轻葡萄糖毒性和预防 2 型糖尿病 (T2D) 等代谢疾病的治疗策略的潜在靶点。
南京大学医学院模式动物研究所博士研究生丁宸云、贾玉环、刘林,大连化物所博士研究生王稳为本文共同第一作者。南京大学医学院模式动物研究所甘振继教授、付婷婷助理教授和大连化物所朴海龙研究员为本文共同通讯作者。该研究得到了国家自然科学基金、科技部、江苏省自然科学基金及中央高校基本科研业务费等多个项目的资助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202502763
图文来源:甘振继实验室
责任编辑:张谨



