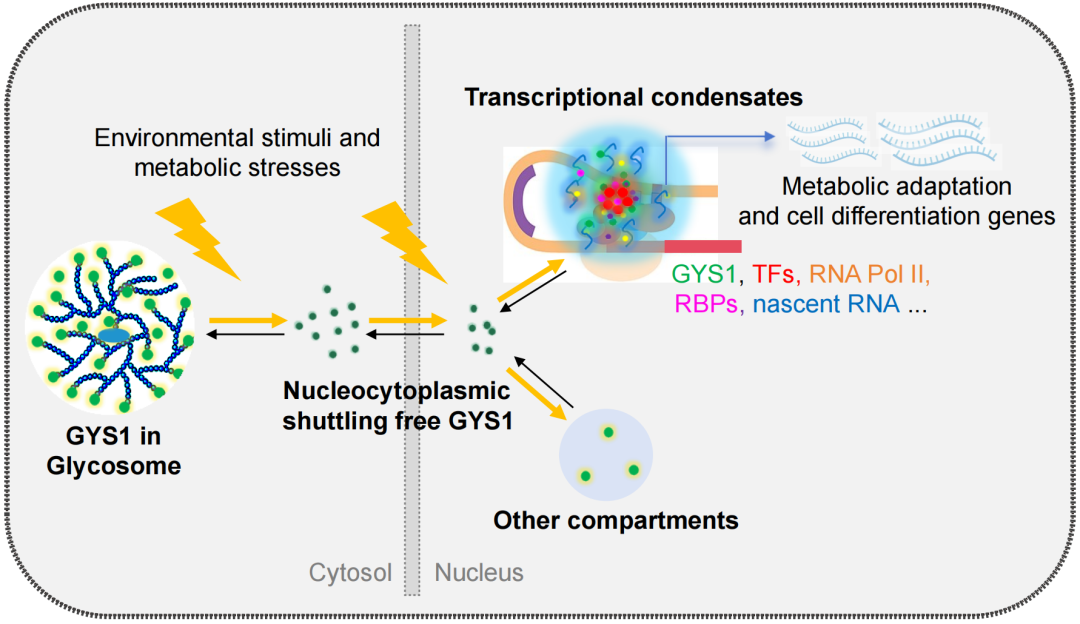
糖原代谢是细胞响应环境应激、维持能量稳态的核心环节。糖原合酶1(GYS1)的经典功能是合成糖原并与之组装形成糖原颗粒 (即糖原体, glycosome)。传统研究主要聚焦于GYS1活性受葡萄糖-6-磷酸(G6P)变构调节及激素调控激酶的磷酸化修饰,其调控异常与糖原累积症和糖尿病等糖代谢疾病密切相关。近年来,代谢酶的“兼职”功能被广泛揭示,部分代谢酶通过核质穿梭参与基因表达和表观遗传调控,从而适应细胞代谢应激并诱导细胞调节性死亡或分化。同时,相分离(phase separation)作为一种大分子区室化调控机制,在转录调控、代谢应激等过程中被广泛关注,但代谢酶通过相分离实现细胞应激的时空调控机制仍知之甚少。
2025年4月8日,中山大学谢小多、冯琳团队联合南京大学医学院模式动物研究所甘振继团队在《Cell Death & Differentiation》杂志上合作发表了题为“The metabolic enzyme GYS1 condenses with NONO/p54nrb in the nucleus and spatiotemporally regulates glycogenesis and myogenic differentiation” 的研究文章。这项工作发现GYS1在细胞核内跟NONO/p54nrb及其他转录因子通过液-液相分离形成动态凝聚体,并阐明了其在糖原合成与肌分化基因转录调控的时空调控机制,为代谢酶的功能多样性提供了新的视角。

主要发现一:GYS1的核内相分离机制。研究发现,在糖原耗竭(如葡萄糖饥饿)条件下,GYS1从细胞质糖原体解离并转位至细胞核形成核内凝聚体。通过TurboID邻近标记和质谱分析,作者鉴定出NONO等核旁斑(paraspeckle)蛋白与核内GYS1相互作用并形成动态液滴。同时作者发现,GYS1是一个RNA结合蛋白,在核内能跟核旁斑长非编码RNA NEAT1_2作用,与NONO等共定位于核旁斑。进一步研究表明,NONO蛋白而非NEAT1_2 RNA是核内GYS1凝聚体形成所必须的,说明GYS1-NONO凝聚体具有独立于核旁斑的生理功能。这些发现突破了GYS1仅在胞浆内发挥糖原合成酶作用的认知,揭示了其作为核内调控因子的新角色。
主要发现二:核内GYS1介导代谢应激与骨骼肌生成的耦合调控。研究通过构建NONO敲除细胞和小鼠模型,发现NONO缺失导致细胞和肌肉内糖原异常积累,NONO敲除小鼠骨骼肌含量下降且运动耐力显著减弱。通过细胞水平的机制研究,作者发现核内GYS1-NONO凝聚体与成肌细胞转录因子MyoD及转录起始复合物组分相互作用,共同形成转录凝聚体,促进肌生成相关基因(如Myogenin、Myomixer)的表达。这一机制将糖原代谢或能量应激直接关联到肌肉分化基因的转录启动,为代谢酶直接参与细胞分化调控提供了新证据。
作者提出,GYS1的核质穿梭受糖原和能量水平动态调控:能量充足时,GYS1合成糖原滞留于细胞质糖原体内;糖原耗竭时,GYS1穿梭至核内形成多功能凝聚体,可通过招募转录机器激活骨骼肌分化基因转录,或通过其他未知机制调控代谢适应。这种“应激-转录-适应”偶联机制不仅能解释运动促进肌肉再生的现象,也为糖原累积症患者肌肉病变现象提供了新的启示。
原文链接:https://www.nature.com/articles/s41418-025-01509-4
图文来源:甘振继实验室
责任编辑:张谨



