骨骼肌是人体最大的组织器官,其正常功能的维持对于全身稳态具有至关重要的作用。肌肉卫星细胞作为骨骼肌的 “干细胞库”,其增殖与分化能力直接决定肌肉损伤后的修复质量与效率。肌肉干细胞再生功能的受损会导致诸多肌病,譬如杜氏肌萎缩症等,严重危害患者的健康和生命安全。在先前的研究中,陈帅/王宏宇团队已经揭示了AS160-STAT3复合体能够进入细胞核共同行使转录调控作用,进而促进肌肉干细胞增殖与肌肉再生。但该复合体的入核调控机制尚不清楚。
2025年11月18日,南京大学医学院模式动物研究所陈帅教授/王宏宇副教授团队在《Nature Communications》发表了题为“TBC1D1 functions as a negative regulator of satellite cells for muscle regeneration”的研究。该研究发现了RabGAP蛋白TBC1D1通过调控AS160-STAT3的核转位,调控肌细胞增殖的作用机制。敲除或敲降TBC1D1能够促进肌肉卫星细胞的增殖活性,从而改善肌肉再生。该研究揭示了TBC1D1作为AS160-STAT3复合体入核调控的关键负向开关。为肌肉损伤修复、肌营养不良等疾病的治疗提供了全新的分子靶点。

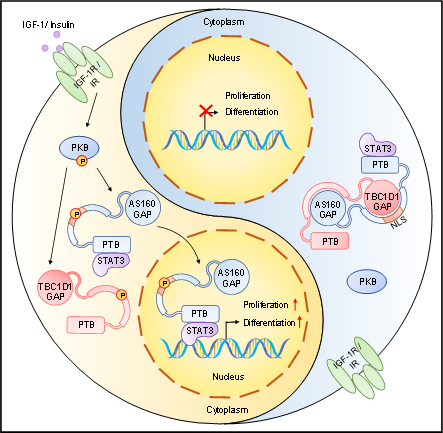
TBC1D1 是与 AS160 相关的 RabGAP 同源蛋白,两者在 N 端均包含两个磷酸酪氨酸结合(PTB)结构域,以及在 C 端包含有一个 RabGAP结构域。与 AS160 类似,TBC1D1上也存在多个PKB下游磷酸化位点,包括 Thr596 位点(与 AS160 上的 Thr642 位点同源)。作为胰岛素与AMPK通路下游的关键调控分子,TBC1D1在组织葡萄糖吸收及脂肪酸利用上都发挥重要调节作用。研究团队发现,TBC1D1的蛋白水平在肌肉损伤初期显著下降,而在修复中后期恢复,提示TBC1D1可能参与肌肉再生调控。与AS160不同,TBC1D1的缺失会显著促进成肌细胞增殖水平。为了研究TBC1D1对于肌细胞增殖及肌肉再生的影响,研究团队分别构建了TBC1D1全身敲除小鼠模型及肌卫星细胞特异性敲除TBC1D1的小鼠模型(TBC1D1-imKO)。发现在两种模型中,TBC1D1的缺失都会显著促进肌卫星细胞的增殖活性以及肌肉再生。为研究TBC1D1调控肌细胞增殖是否依赖其RabGAP结构域活性,研究团队还构建了该结构域失活的TBC1D1R854K小鼠模型,发现该小鼠模型显示出正常的肌肉再生水平,表明TBC1D1调控肌细胞增殖与其RabGAP结构域无关。
进一步研究发现,TBC1D1能够与AS160与STAT3结合形成三元复合体。与AS160不同,TBC1D1不具备核定位序列,也无法进入细胞核,同时它能将AS160-STAT3复合体滞留在细胞质内以阻断其转录调控作用。肌细胞中敲除TBC1D1能够显著促进AS160及STAT3的入核能力。通过一系列蛋白mapping筛选,研究团队发现TBC1D1中段的磷酸化区能够与AS160的RabGAP结构域互作,而AS160中段的磷酸化区同样能够与TBC1D1的RabGAP结构域互作,表明其二者相互作用可能与磷酸化水平有关。团队之前研究表明IGF-1可同时诱导AS160上T642位点及TBC1D1上T596位点的磷酸化,同时IGF-1的刺激同样可以促进AS160与STAT3复合体的核转位。随后研究发现,IGF-1刺激能够促进AS160与TBC1D1的解聚。为进一步明确该磷酸化位点调控作用,研究团队分别构建了AS160T642A以及TBC1D1T596A两种磷酸化失活突变小鼠,发现任一位点的失活均可显著增加二者蛋白互作水平。同时,TBC1D1T596A突变小鼠同样显示出受损的肌肉干细胞增殖水平及肌肉再生修复能力。
最后研究团队还尝试靶向TBC1D1能否对杜氏肌萎缩症的肌肉修复障碍产生治疗作用。研究团队以DMD敲除小鼠(mdx)为模型,构建了TBC1D1与DMD双敲小鼠。发现双敲小鼠的抓力及爆发力相较于mdx小鼠显著增强。此外,双敲小鼠还显示出更大的肌纤维横截面积以及更小的损伤修复区。这些数据表明,靶向TBC1D1能够改善肌肉再生。
综上,该研究首次揭示了TBC1D1能够作为AS160-STAT3复合体核转位的负向开关。IGF-1能够通过磷酸化TBC1D1与AS160从而使二者解聚,随后AS160-STAT3复合体进入细胞核并促进肌细胞增殖及肌肉再生。该研究阐明了TBC1D1调控肌细胞增殖的重要调控作用,同时也探索了靶向TBC1D1治疗杜氏肌萎缩症等肌病的潜在价值。
该论文由南京大学医学院的陈帅教授、王宏宇副教授为本文的共同通讯作者。南京大学医院学院的杨昕宇博士与曹野博士为本文的共同第一作者。本研究还得到了广州生物岛实验室朱大海教授的指导与支持。
本文转载自微信公众号:BioMed科技 ,作者:BioMed科技



