线粒体和溶酶体分别为细胞能量代谢与物质降解的核心细胞器,二者间的功能交流对维持细胞稳态至关重要。然而,在线粒体缺陷状态下,它们如何进行交流以及后续影响尚不清楚。
2025年8月7日,南京大学张青和北京医院中国医学科学院王艳共同通讯在Nature Communications在线发表题为“Impaired mitochondria-initiated crosstalk with lysosomes reciprocally aggravates mitochondrial defect through LManVI”的研究论文。该研究利用dMterf4 RNAi线粒体缺陷果蝇模型,揭示了一种新的线粒体缺陷状态下,由溶酶体α-甘露糖苷酶VI(LManVI)介导的线粒体-溶酶体交流机制。

该实验室之前的研究表明dMterf4 RNAi线粒体缺陷果蝇模型可通过Med8/Tfb4-mtSSB/PolG2/mtDNA-helicase信号轴介导线粒体缺陷,反映了包括线粒体疾病(如联合氧化磷酸化缺陷46)在内的多种线粒体缺陷的共同机制。因此在本研究中,研究人员利用dMterf4 RNAi线粒体缺陷果蝇模型,通过RNA-seq分析发现溶酶体α-甘露糖苷酶VI (LManVI) 表达显著下调,其在哺乳动物中的同源基因Man2B1功能障碍会导致溶酶体贮积症,称为α-甘露糖苷贮积症(AMD)。从机制上讲,研究人员发现,dMterf4 RNAi引发的线粒体缺陷通过Med8/Tfb4-E(z)/pho轴介导溶酶体LManVI的表达下调,从而导致溶酶体功能受损。相反地,下调的LManVI可通过抑制转录辅激活因子PGC-1的表达,进一步下调Tim13、ttm3、ND1、ND3、ND4、ND5、CoI、CoIII、ATPase6、Cytb等多个线粒体相关基因的表达,最终加重了dMterf4 RNAi介导的线粒体缺陷,说明线粒体缺陷后,由LManVI介导的线粒体与溶酶体间的交流可通过一种正反馈的方式进一步加重线粒体缺陷状态。最后,研究者阐明了线粒体与溶酶体间的这种互相交流在哺乳动物细胞中可能是保守的。
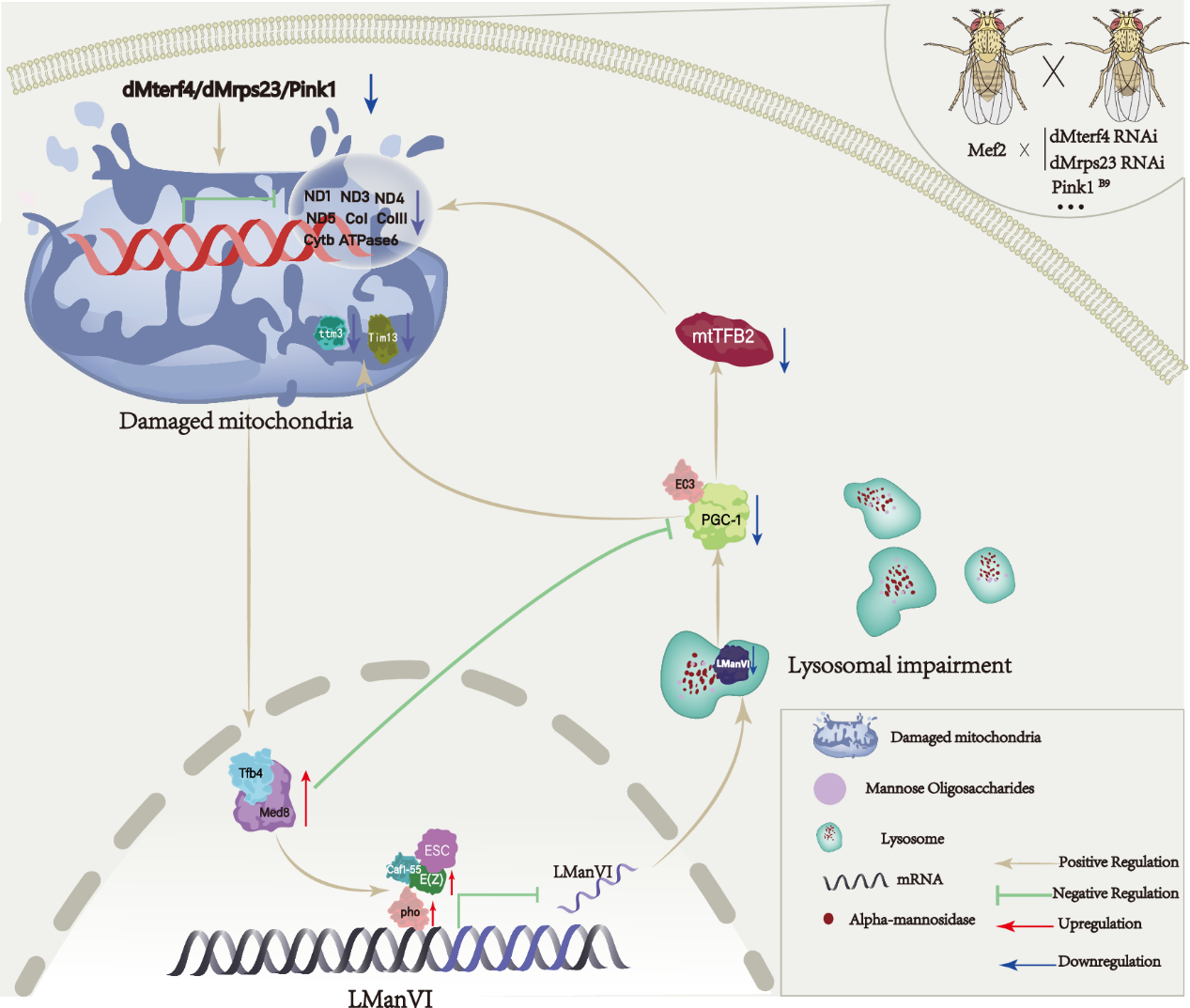
综上所述,本研究揭示了一种在线粒体缺陷状态下线粒体与溶酶体之间的新型互作机制,不仅帮助我们更好的理解线粒体与溶酶体功能稳态的双向调控机制,更重要的是,可能为通过干预线粒体-溶酶体轴来治疗线粒体疾病或溶酶体贮积症开辟了新思路。
南京大学医学院模式动物研究所博士生李胜男、单兆良为本文的共同第一作者。南京大学医学院模式动物研究所张青教授、北京医院中国医学科学院王艳副教授为本文的共同通讯作者。
原文链接:https://www.nature.com/articles/s41467-025-62147-5
图文来源:张青课题组
责任编辑:张谨



