IRG1(Immunoresponsive gene1,又名ACOD1)在免疫调节、炎症反应及肿瘤微环境中有重要作用。实验数据表明,敲除IRG1基因的小鼠模型中,肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)的极化状态可从免疫抑制型的M2表型向抗肿瘤的M1表型转变,从而激活机体的抗肿瘤免疫应答。然而,目前针对IRG1及其代谢产物衣康酸的靶向干预手段仍处于探索阶段,亟需开发更高效的治疗策略。
基于RNA干扰的技术可通过siRNA特异性沉默目标基因的表达,但其在活体内的递送效率和稳定性仍是技术难点。脂质纳米颗粒(lipid nanoparticle,LNP)因其优异的载体特性,成为实现核酸药物靶向递送的理想工具。
2025年6月22日,复旦大学生物医学研究院叶丹、陈磊蕾课题组联合南京大学医学院模式动物研究所李颜课题组在Protein & Cell 杂志以封面文章发表了题为" Targeting IRG1 in tumor-associated macrophages for cancer therapy "的研究论文,该研究创新性地利用LNP包裹siRNA,成功实现了对TAMs中IRG1基因的高效沉默。

动物实验结果显示,这一策略显著降低了肿瘤微环境中IRG1及衣康酸水平,并在结肠癌和黑色素瘤模型中展现出显著的抑瘤效果。
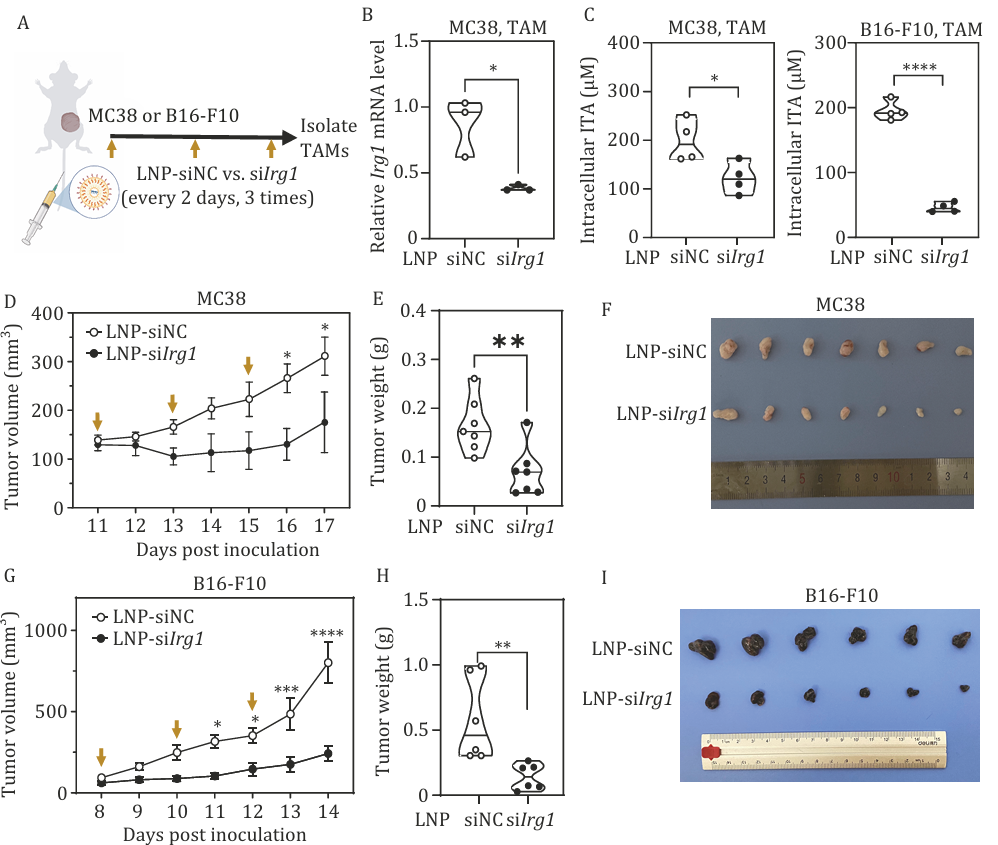
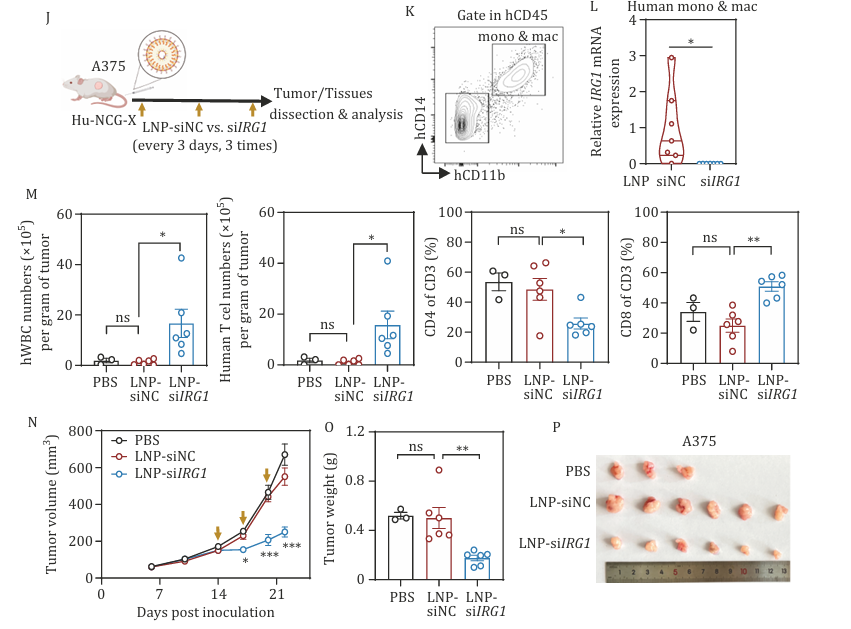
为验证该疗法的临床转化价值,研究团队建立了免疫系统人源化小鼠模型。该模型通过将人类造血干细胞移植至免疫缺陷小鼠体内,成功实现了包括T细胞、B细胞及巨噬细胞等多个人类免疫细胞亚群的重建。这一创新模型为研究人类肿瘤免疫微环境提供了重要平台。实验结果显示,在接受LNP-siIRG1治疗的人源化黑色素瘤模型中,肿瘤组织内CD8+ T细胞的浸润水平显著提升。
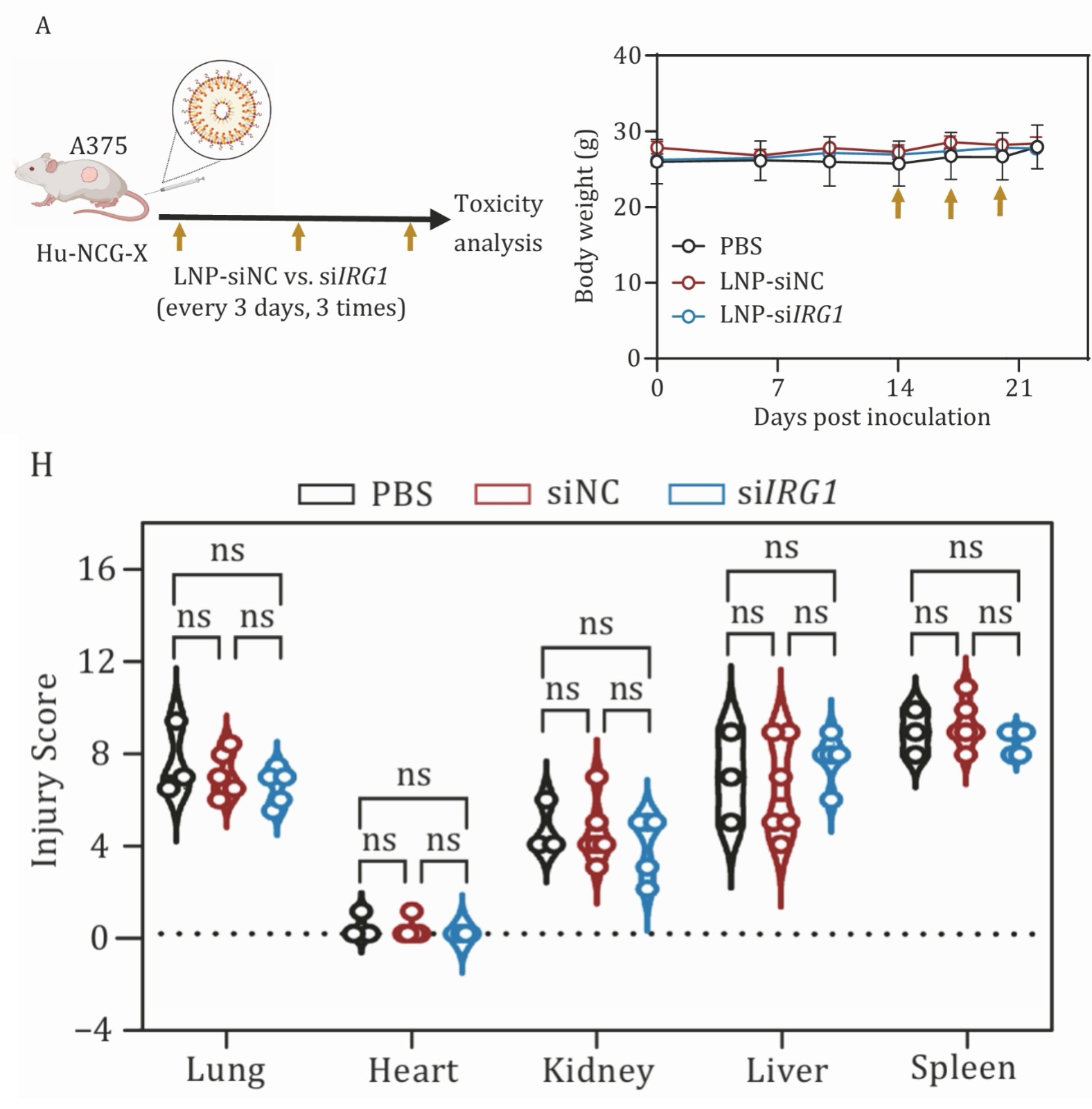
在安全性评估方面,治疗过程中未观察到明显的毒性反应,小鼠体重保持稳定,血液中炎症因子水平未见异常,表明该治疗方案具有良好的安全性特征。这些发现为后续临床研究提供了重要的实验依据。
综上所述,这项研究证实了靶向IRG1的LNP-siRNA递送系统在肿瘤免疫治疗中的有效性,为人源化模型在药物开发中的应用提供重要参考,该成果为开发新型癌症免疫疗法开辟新的研究方向。
南京大学模式动物研究所博士研究生刘爽、复旦大学生物医学研究院博士研究生魏林星、南京大学模式动物研究所硕士研究生余倩和复旦大学基础医学院的博士研究生郭志伟为本文共同第一作者。复旦大学生物医学研究院的叶丹教授,陈磊蕾副研究员,以及南京大学医学院模式动物研究所的李颜教授为共同通讯作者。
原文链接:https://doi.org/10.1093/procel/pwaf012
图文来源:李颜课题组
责任编辑:张谨



