听神经病是一种罕见的耳聋形式,其特征是听觉脑干反应缺失或异常。常染色体显性非综合征听神经病(AUNA1)是由Formin家族基因DIAPH3的5'UTR单碱基突变导致蛋白表达增加引起的。Diaph3的表达和活性受到严格调控: 转基因小鼠过表达Diaph3会导致听力损失,而Diaph3敲除则会导致发育缺陷和胚胎死亡。因此,如何调控DIAPH3的表达和活性将为治疗AUNA1带来新的希望。Diaph3蛋白内多重结构域聚合形成的自抑制等相互作用精密调控其肌动蛋白聚合活性,然而,这些相互作用对Diaph3蛋白稳定性和活性的生理意义尚不完全清楚。
2024年9月24日,南京大学医学院模式动物研究所在国际学术期刊Journal of Biological Chemistry上发表了题为“Stub1 promotes degradation of the activated Diaph3: a negative feedback regulatory mechanism of the actin nucleator”的研究成果。基于细胞和小鼠模型,研究人员揭示了一种新的Diaph3蛋白质稳定性和活性的负反馈调节机制,即活性的Diaph3易被E3泛素连接酶Stub1泛素化并降解以防止过度的肌动蛋白聚合,维持正常的毛细胞和听觉神经元功能。

作为Formin家族蛋白,Diaph3通过激活肌动蛋白聚合调节许多细胞骨架依赖的细胞过程。已知Diaph3蛋白内相互作用包括其DID-DAD结构域的分子内相互作用和DD-DD结构域或FH2-FH2结构域的分子间相互作用。在本研究中,研究人员发现FH2-FH2相互作用促进了Diaph3活性,而DID-DAD和DD-DD相互作用通过不同的机制抑制了Diaph3活性。DID-DAD相互作用抑制Diaph3蛋白的活性,而Rho-GTPases的结合会破坏这种抑制作用。有趣的是,研究人员发现DID-DAD相互作用能稳定DID或DAD结构域免受蛋白酶体介导的降解。RhoA结合或M1041A突变破坏了DID-DAD相互作用,导致Diaph3活性增加以及活性的Diaph3蛋白降解加速。此外,活性的Diaph3易被E3泛素连接酶Stub1泛素化并降解,在小鼠耳蜗中敲低Stub1会导致毛细胞的纤毛缺陷、神经元退化和听力损失,这与过表达Diaph3的小鼠表型相似。根据以上的结果,本研究揭示耳聋基因DIAPH3活性调控的负反馈机制,为AUNA1以及因同家族DIAPH1基因突变导致的DFNA1耳聋诊治提供新的思路。
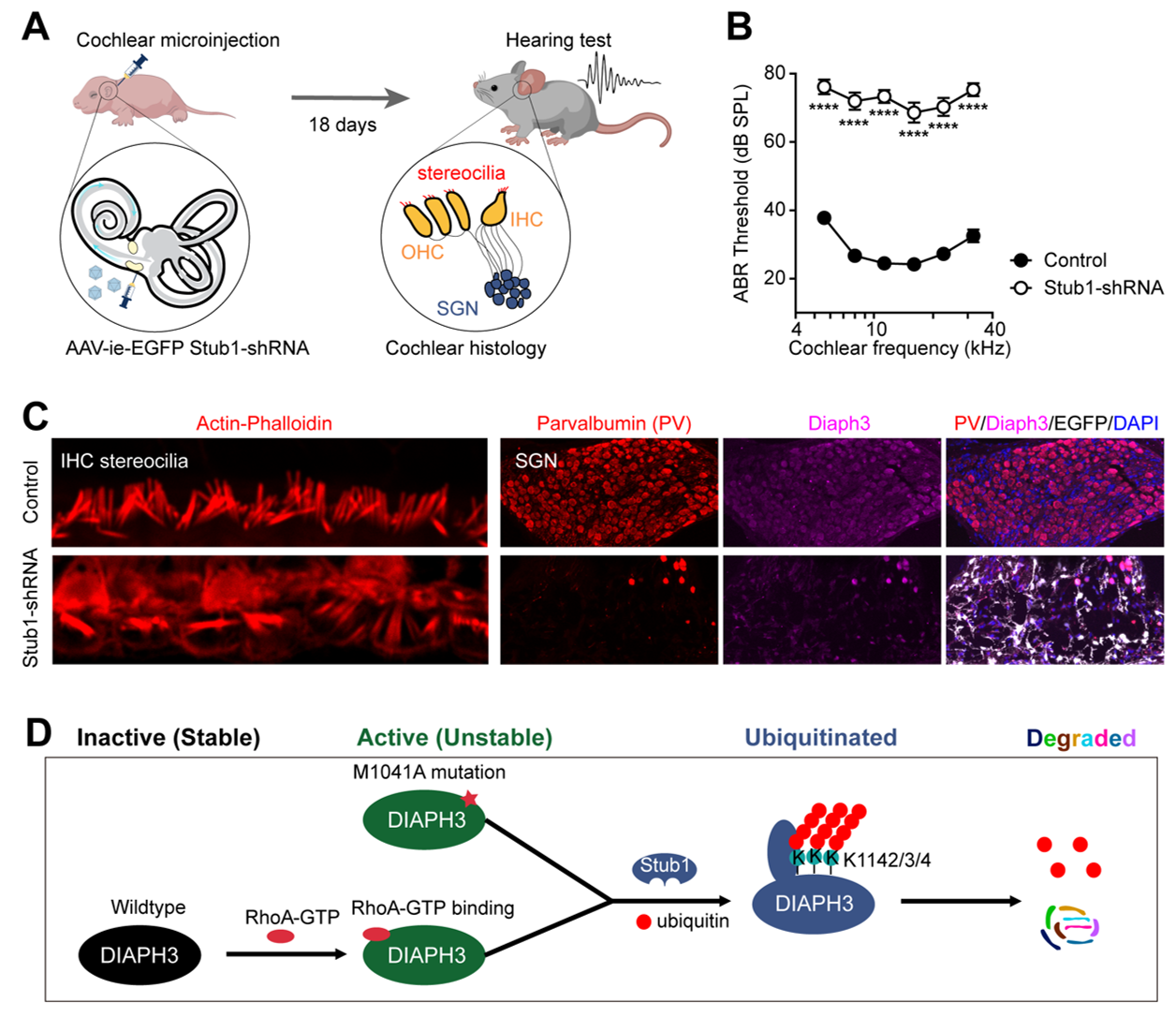
Stub1调控Diaph3的表达活性促进听觉功能的维持
(A) Stub1敲降实验示意图;(B)Stub1敲降导致听力损失;(C)听力损失伴随毛细胞纤毛紊乱和听觉神经元死亡;(D)Diaph3活性负反馈调控机制。
南京大学博士生裘翠、张琳晴为本文的共同第一作者。南京大学万国强、南通大学附属医院张鲁平、南京鼓楼医院麻晓峰、王俊国为本文的共同通讯作者。该研究工作得到了国家自然科学基金重大、面上、青年基金和江苏省自然科学基金等多项研究资助。
原文链接:https://www.jbc.org/article/S0021-9258(24)02314-7/fulltext
图文来源:万国强课题组
责任编辑:张谨



