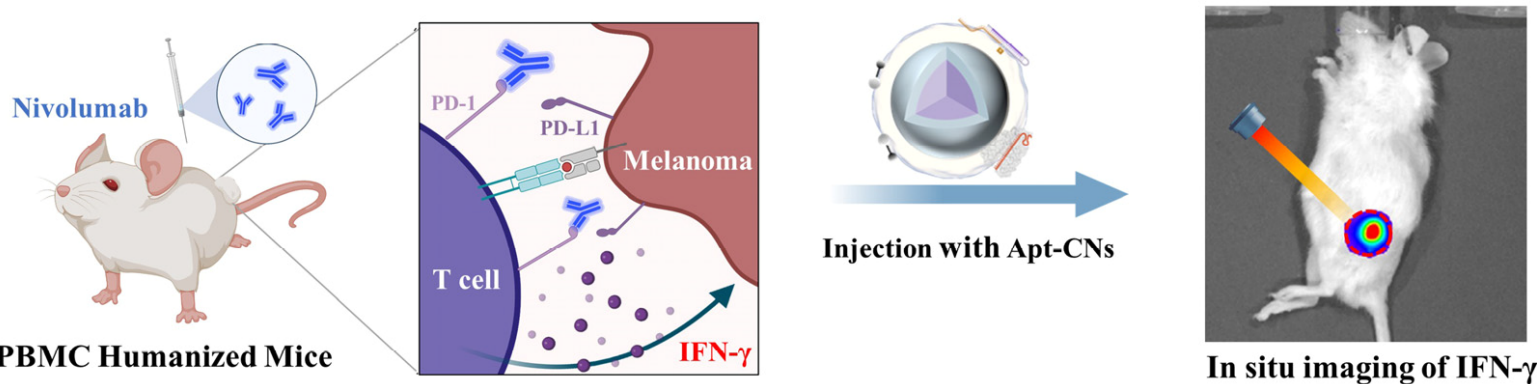
免疫检查点阻断(ICB)疗法通过激活机体免疫系统来对抗癌症,展现出了巨大的治疗潜力。然而,ICB治疗的临床疗效常常受到免疫反应的复杂性和肿瘤微环境(TME) 异质性的影响。研究者们已经通过分析外周血中的淋巴细胞和相关细胞因子来评估ICB疗法的免疫反应,其中,干扰素γ (IFN-γ)作为一种关键细胞因子,由激活的T细胞或细胞毒性T淋巴细胞(CTLs)产生,被视为评估有效免疫激活的重要生物标志物。
2024年1月11日,南京大学李颜教授课题组联合南京大学张晶晶副教授课题组在ACS Nano发表了题为“Photoactivatable Aptamer-CRISPR Nanodevice Enables Precise Profiling of Interferon-Gamma Release in Humanized Mice“的研究成果。该研究为提高免疫检查点阻断治疗中细胞因子成像的灵敏度和精度提供了一个新工具,为成像引导的肿瘤治疗研究提供了新的启示。

该研究通过设计嵌入适体的紫外线可切割PC-DNA探针,并与UCNP和CRISPR-Cas12a增强荧光系统进一步整合,构建了一种时空可控的纳米装置,该装置能够在体外及体内准确地原位成像T细胞释放的IFN-γ。在植入人外周血单个核细胞(PBMC)的人源化小鼠模型中,该纳米装置能够定量成像肿瘤中内源性IFN-γ及其对anti-PD-1治疗的动态响应。
南京大学研究生刘政,段翔和云阳方为本文的共同第一作者。南京大学张晶晶副教授,李颜教授为本文的共同通讯作者。研究得到合作实验室的大力协助与支持。上述研究得到了中国科学技术部、国家自然科学基金委、教育部、江苏省科技厅以及中央高校等基金的支持。
原文链接:https://doi.org/10.1021/acsnano.3c12499
图文来源:李颜课题组
责任编辑:张谨



