2023年8月17日,南京大学模式动物研究所林兆宇和高翔课题组在Cell Death & Differentiation上发表了题为“Apoptotic caspase-7 activation inhibits non-canonical pyroptosis by GSDMB cleavage”的研究论文。该研究阐释了Gasdermin B(GSDMB)在细胞自主(cell-autonomous)调控中调节凋亡和非经典焦亡的功能,并为脓毒症的治疗提供了新的治疗策略。
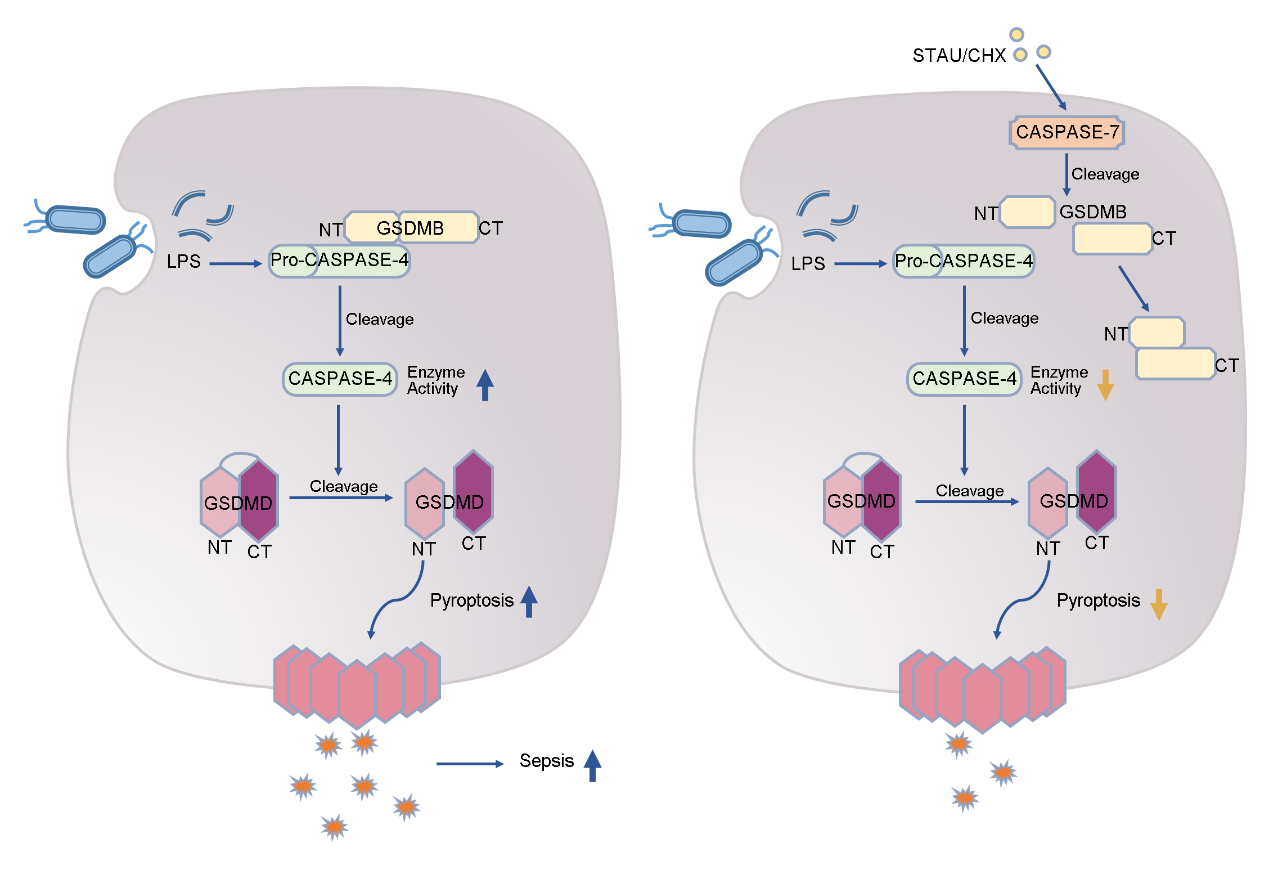
图1. 凋亡过程中caspase-7通过切割GSDMB抑制非经典焦亡
细胞焦亡是一种炎性死亡方式,根据途径的不同可分为经典与非经典两种方式。细胞内的细菌或其LPS能够激活caspase-4/5及小鼠直系同源物caspase-11,导致非经典焦亡的发生,释放多种炎性因子。相对的,凋亡是一种温和的非炎性细胞死亡方式,二者之间的平衡在炎性疾病中起重要作用。在实验室先前的研究中,GSDMB被发现能够在非经典焦亡中增加caspase-4的酶活性。而凋亡的重要执行者caspase-3/7能够切割GSDMB,这一现象表明caspase-3/7/GSDMB通路可能在非经典焦亡与凋亡的平衡之间发挥作用。
该研究在使用staurosporine(STAU)诱导细胞凋亡后再使用LPS诱导细胞发生焦亡时发现,STAU的前处理会显著降低细胞由LPS诱导的焦亡水平,而GSDMB在该过程中被切割。对STAU与LPS处理的细胞进行流式细胞分选结果表明,STAU的前处理会使LPS处理后发生焦亡的细胞比例显著减少,表明GSDMB的剪切与凋亡对非经典焦亡的抑制存在联系。
为了寻找在凋亡抑制非经典焦亡过程中起到切割GSDMB的关键作用的caspase,研究者将目光聚焦在已知能够切割GSDMB的两种caspase家族成员——caspase-3与caspase-7上。在使用siRNA分别敲降两种caspase,并检测了STAU与LPS处理后Gasdermin D(GSDMD)的剪切与LDH的释放水平后,确认了凋亡对非经典焦亡的抑制作用是依赖caspase-7,而不是caspase-3。通过进一步的细胞生化实验,研究者证明了凋亡过程中被激活的caspase-7能够在D91位点切割GSDMB。被切割的GSDMB C端(92-417 aa)能够通过抑制GSDMB(1-91 aa)与caspase-4的相互作用从而抑制非经典焦亡的发生。
由于啮齿动物的基因组中不存在GSDMB的同源基因,因此为了更好地探究caspase-7/GSDMB通路相关的凋亡抑制非经典焦亡在体内的生理功能,研究者使用BAC转基因构建了GSDMB转基因小鼠。在LPS诱导的脓毒症模型中,转入GSDMB且敲除caspase-7会导致小鼠出现更低的生存率与更严重的肺部炎症。此外,研究者还使用E.coli与S. Typhimurium感染骨髓来源的巨噬细胞(BMDM)和人类THP-1细胞系,模拟细胞面对外界刺激时对凋亡与非经典焦亡的自主调控,发现敲除或敲降caspase-7能够增强细胞因细菌感染引起的非经典焦亡,进而说明凋亡对非经典焦亡的抑制能够在细菌感染的过程中起到自我保护的功能。
综上所述,本研究发现并阐明了通过caspase-7/GSDMB通路实现的凋亡对非经典焦亡的抑制作用。由于在非经典焦亡过程中,GSDMB能够结合caspase-4并增强其酶活性,因此GSDMB是脓毒症的潜在促炎因子。而caspase-7激活后能够抑制GSDMB对非经典焦亡的促进作用,避免细菌感染过程中免疫反应的过度激活以实现自我保护,因此caspase-7/GSDMB通路有望作为潜在靶点,为临床上脓毒症的治疗提供新的治疗策略。
南京大学医学院模式动物研究所林兆宇副教授、高翔教授是本研究论文的共同通讯作者,李旭、张天逊为共同第一作者。
论文链接:https://www.nature.com/articles/s41418-023-01211-3
论文在线阅读链接:https://rdcu.be/djJ2E



