2022年7月25日,南京大学医学院模式动物研究所陈帅/王宏宇课题组在《Nature Communications》上在线发表了题为 “The RalGAPα1−RalA signal module protects cardiac function through regulating calcium homeostasis”的研究成果 [1](全文下载链接:https://doi.org/10.1038/s41467-022-31992-z)。该研究发现RalGAPα1-RalA信号轴可响应心脏压力诱导的刺激、通过改善SERCA2a转运钙离子能力起到心脏保护作用,揭示了压力过载型心肌病发病新机理,为此类心肌病的防治提供了新思路和潜在药物研发靶点。

高血压引发的心脏功能障碍是心血管疾病高发病率和高死亡率的重要原因,它会使心脏从最初的适应性肥大发展成为病理性肥大,其特征是左心室增大,伴有心室壁和隔膜壁的变薄 [2]。但是,压力超负荷到底是如何引起心脏结构和分子变化的机制尚不完全清楚。
RalA和RalB是细胞内两种高度同源的Ral-GTPase,可调节多种细胞过程,包括胞吐作用、增殖和自噬 [3];其GTP酶活性受上游调节因子Ral-GTPase活化蛋白(RalGAP)复合物调控[5,6]。RalGAP复合物由一个催化亚基和一个调节亚基组成,其中催化亚基存在RalGAPα1和α2两种亚型 [4,5]。催化亚基只有与调节性RalGAPβ亚基结合形成复合物后,才能保持其稳定性和功能,将RalA/RalB从其GTP结合状态转变为GDP结合形式 [4,5]。研究团队之前发现RalGAPα1/β复合体是心肌和骨骼肌中的主要RalGAP复合物,该复合物在骨骼肌中是糖脂代谢以及胰岛素抵抗发生中的关键调控因子[6,7]。然而,RalGAPα1/β复合物在心脏中的功能以及作用机制之前尚未见报道。
研究人员首先利用横断主动脉缩窄术(TAC)制备压力过载型心肌病小鼠模型,发现在TAC小鼠模型的心脏中RalGAPα1复合物的蛋白水平显著增加。为进一步探究RalGAPα1复合物在心脏中的功能,研究人员构建了心肌细胞特异性敲除的小鼠模型(RalGAPα1-cKO),发现心肌细胞中RalGAPα1缺失会损害小鼠心功能。有意思的是,RalGAPα1缺失也加剧了TAC诱导的心脏重塑,并导致比对照小鼠更高的死亡率。这些结果表明RalGAPα1复合物对压力超负荷的心脏起到重要的保护作用。虽然RalGAPα1在骨骼肌中调控糖脂代谢 [7,8],但是研究人员发现RalGAPα1缺失并不会影响心脏能量水平以及对能量底物偏好性。那么RalGAPα1究竟是如何参与心脏功能调节的呢?
为回答这一问题,研究人员利用蛋白质组学方法寻找RalGAPα1的结合蛋白。通过这一方法,他们发现了肌浆网钙泵SERCA2a是RalGAPα1的相互作用蛋白。SERCA2a介导Ca2+从细胞浆到肌浆网的回收,而肌浆网和细胞浆之间的钙循环决定了心肌细胞的收缩和松弛。压力超负荷会破坏心脏中的钙循环并导致细胞浆Ca2+的增加,从而削弱心脏的收缩力;SERCA2a功能障碍会严重加速心力衰竭 [8]。SERCA2a功能受多种机制调节,包括PLB结合、SUMO酰化和乙酰化等。研究团队之前研究表明SERCA2a还受磷酸化调控,横纹肌特异性表达的蛋白激酶SPEG可磷酸化SERCA2a上T484位点,提高其转运钙离子的能力从而维持心脏功能 [9]。因此,研究人员针对RalGAPα1对SERCA2a的潜在作用展开了深入研究。研究发现,过表达RalGAPα1可促进SERCA2a形成高活性的多聚体,加速心肌细胞肌浆网回收Ca2+;而敲除RalGAPα1可降低SERCA2a多聚体水平,抑制心肌细胞肌浆网回收Ca2+。RalGAPα1对心肌细胞钙稳态的调控依赖其GAP活性,其下游是由RalA而不是RalB介导。特别有意思的是,研究人员发现GDP结合的RalA可直接与SERCA2a相互作用,促进后者的多聚体化,从而增强其钙转运能力。而经典意义上的GTP结合的活性RalA没有此种作用。
为进一步探究该机制的体内作用以及是否可用于压力过载型心肌病的治疗,研究人员在TAC小鼠模型中通过腺相关病毒载体表达GDP结合形式的RalAS28N突变体。与细胞实验结果一致的是,在小鼠体内提高GDP结合形式的RalA可阻断压力过载引起的SERCA2a多聚体下降,恢复压力过载扰乱的心肌细胞钙稳态,从而改善压力过载情况下的心功能。由于GDP结合形式的RalAS28N突变体属于经典意义上的非活性RalA,它有可能避免其它生物学途径过度激活引发的副作用。关于GDP结合形式的RalA是否具有其它作用需要进一步研究。
综上,该研究发现了RalGAPα1-RalA信号通路响应压力诱导的刺激,通过加强心肌细胞肌浆网上SERCA2a的钙回收能力来维持心脏功能,从而起到心脏保护作用。这一发现可为压力过载型心肌病以及其它以钙超载为特征的心力衰竭提供新的药物研发思路和分子靶标。
模式所朱桑桑博士、副研究员全超为该论文共同第一作者,陈帅教授和王宏宇副教授为通讯作者。该研究工作得到了国家科技部、国家自然科学基金委以及江苏省科技厅的基金支持。
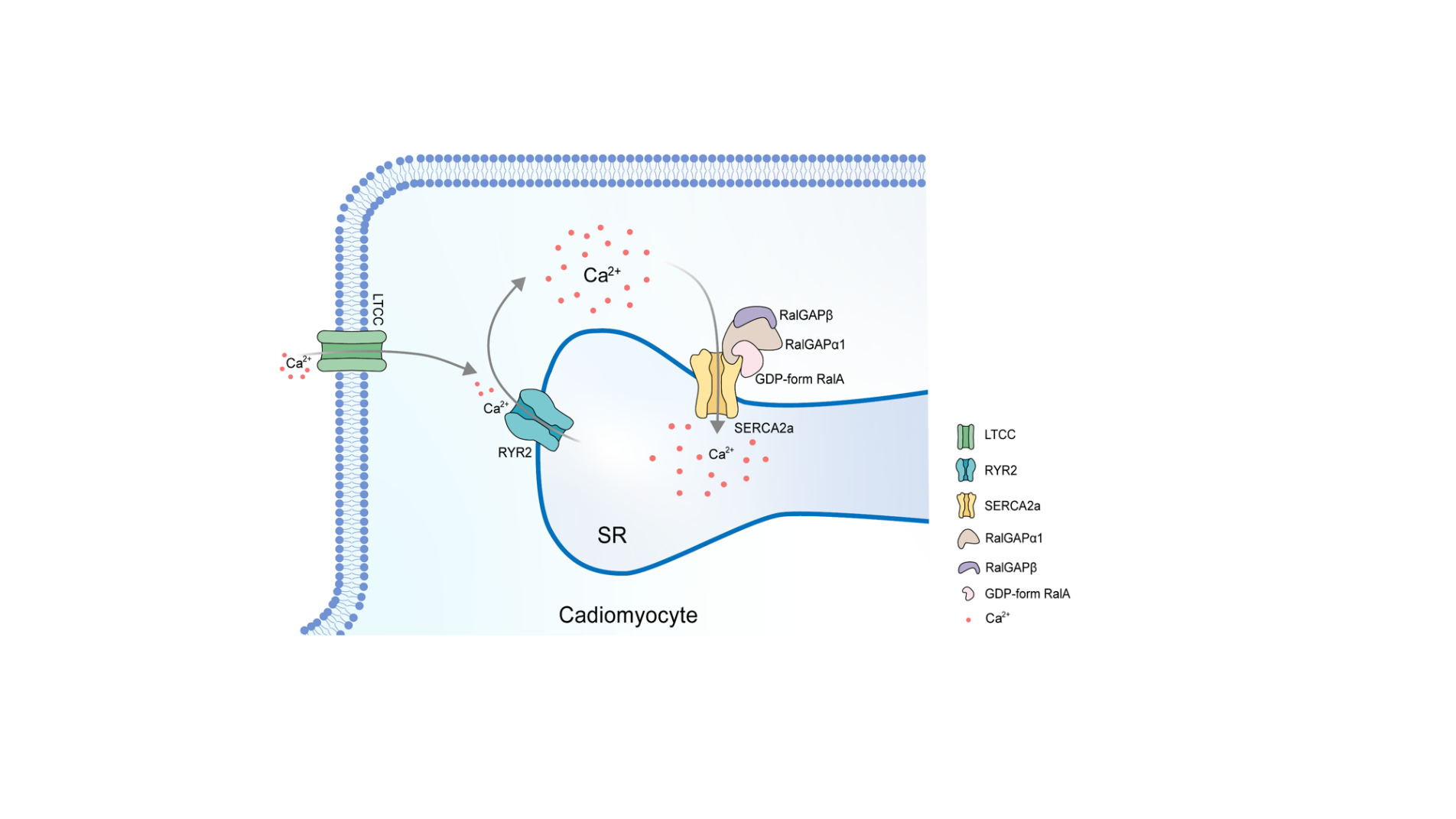
图一. RalGAPα1-RalA通路调节SERCA2a功能的模式图(摘自Nat Commun 2022,13:4278)
参考文献:
1. Zhu, S.S., et al. The RalGAPa1-RalA signal module protects cardiac function through regulating calcium homeostasis. Nat Commun 13, 4278 (2022).
2. Oatmen, K.E., et al. Heart failure as interstitial cancer: emergence of a malignant fibroblast phenotype. Nat Rev Cardiol 17, 523-531 (2020).
3. Gentry, L. R., et al. Ral small GTPase signaling and oncogenesis: More than just 15minutes of fame. Biochim Biophys Acta 1843, 2976-2988 (2014).
4. Shirakawa, R., et al. Tuberous sclerosis tumor suppressor complex-like complexes act as GTPase-activating proteins for Ral GTPases. J Biol Chem 284, 21580-21588 (2009).
5. Chen, X.W., et al. A Ral GAP complex links PI 3-kinase/Akt signaling to RalA activation in insulin action. Mol Biol Cell 22, 141-52 (2011).
6. Chen, Q., et al. GARNL1, a major RalGAPa subunit in skeletal muscle, regulates insulin-stimulated RalA activation and GLUT4 trafficking via interaction with 14-3-3 proteins.Cell Signal 26, 1636-1648 (2014).
7. Chen, Q., et al. Targeting RalGAPalpha1 in skeletal muscle to simultaneously improve postprandial glucose and lipid control. Sci Adv 5, eaav4116 (2019).
8. Kho, C., et al. Altered sarcoplasmic reticulum calcium cycling—targets for heart failure therapy. Nat Rev Cardiol 9, 717-733 (2012).
9. Quan, C., et al. SPEG Controls Calcium Reuptake Into the Sarcoplasmic Reticulum Through Regulating SERCA2a by Its Second Kinase-Domain. Circ Res 124, 712-726 (2019).



