2022年7月8日,模式所陈帅/王宏宇课题组在Nature Communications上在线发表了题为 TRIM24 is an insulin-responsive regulator of P-bodies 的研究成果[1](全文下载https://www.nature.com/articles/s41467-022-31735-0)。这项工作发现了TRIM24 作为P-bodies的胰岛素响应调节因子调控肝脏脂质代谢的新机理,为脂肪肝的防治提供了新思路和重要分子治疗靶点。

胰岛素在控制能量代谢中具有至关重要的作用,餐后胰岛素大量分泌到血液中促进葡萄糖、脂肪酸以及氨基酸的吸收来调节全身能量稳态[2]。胰岛素结合并激活受体激酶,通过胰岛素受体底物(IRS) −磷脂酰肌醇-3-激酶 (PI3K)-蛋白激酶B (PKB,也称为Akt)信号通路磷酸化下游不同的底物,而底物的多样性也将不同的生理结果与胰岛素信号传导相连接,从而维持代谢稳态。胰岛素对代谢稳态的调控作用部分是通过基因表达调控实现的。胰岛素可在多个层面参与基因表达调控,包括mRNA 转录和翻译。mRNA 稳定性调节是基因表达调控的重要一环,之前的研究提示胰岛素可能与调节mRNA 稳定性的加工体(processing body,P-body)有联系[3,4]。然而,胰岛素是否以及如何通过 P-body调节 mRNA 稳定性尚不清楚。
为研究胰岛素在体内的作用机理,研究人员通过磷酸化蛋白质组学方法分离了小鼠肝脏中受胰岛素调控的磷酸化靶蛋白,其中鉴定到一个新的胰岛素响应蛋白TRIM24(又名TIF1a)。TRIM24是一个TRIM家族的E3泛素连接酶,在基础状态下主要存在于细胞核中、调节基因转录。研究人员发现,胰岛素刺激可显著将TRIM24转位到细胞浆中,形成点状结构。进一步研究发现,胰岛素刺激下,蛋白激酶PKB可磷酸化TRIM24碳端、位于其第2个核定位序列中的丝氨酸1043位点,该磷酸化事件可促使TRIM24在核输出蛋白XPO1的帮助下从细胞核转位到细胞浆中。
为进一步研究TRIM24在胞浆中的作用,研究人员通过蛋白组学手段分析了与TRIM24互作蛋白,发现TRIM24可与多种P-body蛋白组分结合,包括DDX6、LSM1、EDC4和AGO1/2,其中TRIM24可泛素化EDC4和AGO2。TRIM24泛素化EDC4可降低后者与脱帽酶组分DCP1互作,影响脱帽酶复合体形成。
为回答TRIM24这一调控机制的体内功能,研究人员制备了两种TRIM24基因突变小鼠,即TRIM24-E3泛素连接酶活性丧失点突变小鼠(TRIM24C52/55A突变小鼠)和丝氨酸1043位点磷酸化失活的点突变小鼠(TRIM24S043A突变小鼠)。有意思的是,在高脂饮食喂养下,这两种基因突变都能显著缓解肝脏的脂肪变性。通过RNA测序,研究人员发现TRIM24C52/55A突变小鼠肝脏的PPARγ通路下调;同样的,TRIM24S043A突变小鼠肝脏PPARγ通路也下调。其机理是胞浆中的TRIM24-E3泛素酶活性缺失,导致Pparγ的mRNA经由P-body降解加速,进而肝细胞脂质积累减少;而恢复PPARγ表达可恢复肝细胞中脂质积累。
综上,该研究发现了TRIM24 是一个新的胰岛素响应蛋白。胰岛素刺激可使其从细胞核转位到细胞浆中,调控P-body功能,进而调控Pparγ的mRNA稳定性,从而调控肝脏脂质代谢。这一新的胰岛素作用机理可为脂肪肝的治疗提供新的潜在药物研发靶标。
模式所博士研究生韦雯、副研究员陈俏利、博士研究生刘敏君、盛杨博士为该论文共同第一作者,陈帅教授和王宏宇副教授为通讯作者。该研究工作得到了国家科技部、国家自然科学基金委以及江苏省科技厅的基金支持。
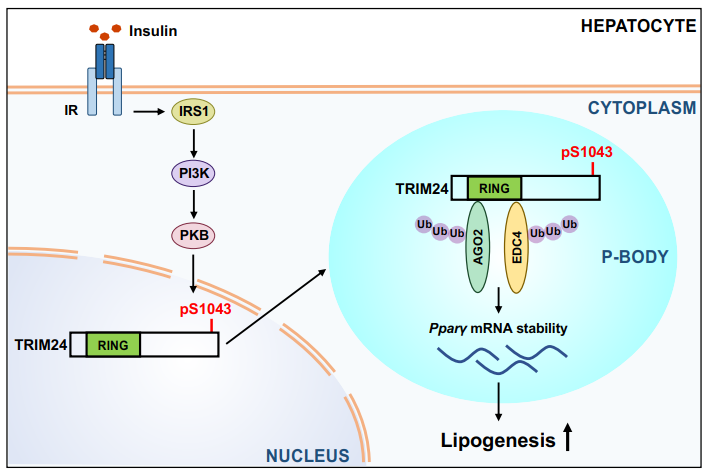
图一 TRIM24响应胰岛素通路调节P-body功能的模式图(摘自Nat Commun 2022, 13,3972)
参考文献:
1. Wei, W., Chen, Q.L., Liu, M.J., Sheng, Y., et al., TRIM24 is an insulin-responsive regulator of P-bodies. 2022. 13, 3972.
2. Czech, M.P., Insulin action and resistance in obesity and type 2 diabetes. Nat Med, 2017. 23(7): p. 804-814.
3. Burn, K.M., et al., Somatic insulin signaling regulates a germline starvation response in Drosophila egg chambers. Dev Biol, 2015. 398(2): p. 206-17.
4. Karimian Pour, N. and K. Adeli, Insulin silences apolipoprotein B mRNA translation by inducing intracellular traffic into cytoplasmic RNA granules. Biochemistry, 2011. 50(32): p. 6942-50.



