世界上有大约15亿人仍在遭受蠕虫感染的痛苦。近几年一系列研究发现蠕虫感染后,肠道上皮层会通过增加杯状细胞(goblet cell)和簇细胞(tuft cell)的分化和“警报素”白介素-25和33的分泌等手段激活肠道组织内的二型免疫反应,并杀死和清除病原微生物。与此同时,二型免疫反应的失调也是造成发达国家中自身免疫疾病和过敏性疾病高发的原因。然而,肠道二型免疫反应在分子层面的激活和调控机制尚不十分清楚。
2022年4月5日,南京大学模式动物研究所高翔、林兆宇课题组和美国明尼苏达大学阮海斌课题组在国际著名学术期刊Immunity在线发表了题为“Epithelial STAT6 O-GlcNAcylation drives a concerted anti-helminth alarmin response dependent on tuft cell hyperplasia and Gasdermin C”的研究成果。此项结果揭示了肠道上皮细胞中STAT6转录因子的O-乙酰糖胺修饰(O-GlcNAc)介导的Pou2f3和Gasdermin C(GSDMC)表达,分别是造成簇细胞增生和IL-33分泌增加的重要机制。
在此研究中,作者首先发现肠道蠕虫感染可以显著增加肠道中蛋白O-乙酰糖胺修饰的水平。而肠上皮特异性敲除O-乙酰糖胺修饰的小鼠丧失了抗蠕虫感染的免疫反应,包括簇细胞和杯状细胞的增生和多种细胞因子的表达。而进一步在小鼠成熟簇细胞和肠干细胞中分别敲除O-乙酰糖胺修饰的实验证实了O-乙酰糖胺修饰主要作用为调控肠干细胞向不同成熟细胞的分化。
由于STAT6转录因子调控了肠干细胞向簇细胞的分化,作者着重研究了O-乙酰糖胺修饰对STAT6的调节。通过液相色谱的方法,作者发现了STAT6上的多个O-乙酰糖胺修饰位点。继而作者在肠道上皮类器官中通过一系列基因编辑的手法证实了STAT6的O-乙酰糖胺修饰可以独立于Y641位点的磷酸化修饰调节簇细胞调控因子Pou2f3的表达,进而影响簇细胞的分化和IL-25的分泌。
蠕虫感染后,肠道上皮除增加簇细胞和“警报素”IL-25的分泌外,还会增加白介素-33(IL-33)来激活二型固有免疫细胞和T辅助细胞。然而由于缺乏用于分泌的信号肽段,白介素-33不通过高尔基体途径分泌,IL-33的主动分泌调节机制一直未被阐明。研究中作者发现STAT6的O-乙酰糖胺修饰可以显著增加GSDMC的表达。而GSDMC蛋白的N段聚合物(GSDMCN)可以在细胞膜打孔,介导IL-33分泌和抵抗蠕虫感染。有意义的是,肠炎发生伴随着GSDMC的过量表达,而GSDMC敲除小鼠可以抵抗DSS和IL-10敲除引起的肠炎。该研究首次阐明了Gasdermin家族中研究甚少的GSDMC蛋白的非焦亡机制和生理作用。
综上所述,本研究通过一系列转基因动物模型、类器官培养和分子生物学等研究手段,发现了STAT6的O-乙酰糖胺修饰是诱导肠道上皮抗蠕虫二型免疫反应的重要分子信号。它通过增加簇细胞分化和GSDMC表达,协调IL-25和IL-33两个“警报素”的分泌来激活二型炎症和清除蠕虫。这些发现不仅拓展了抗寄生虫感染的治疗思路,也为其它与二型免疫反应失调相关的疾病提供了新的干预靶点。
南京大学医学院模式动物研究所林兆宇副教授和美国明尼苏达大学阮海斌教授是本研究论文的共同通讯作者。明尼苏达大学博士后赵明为第一作者。
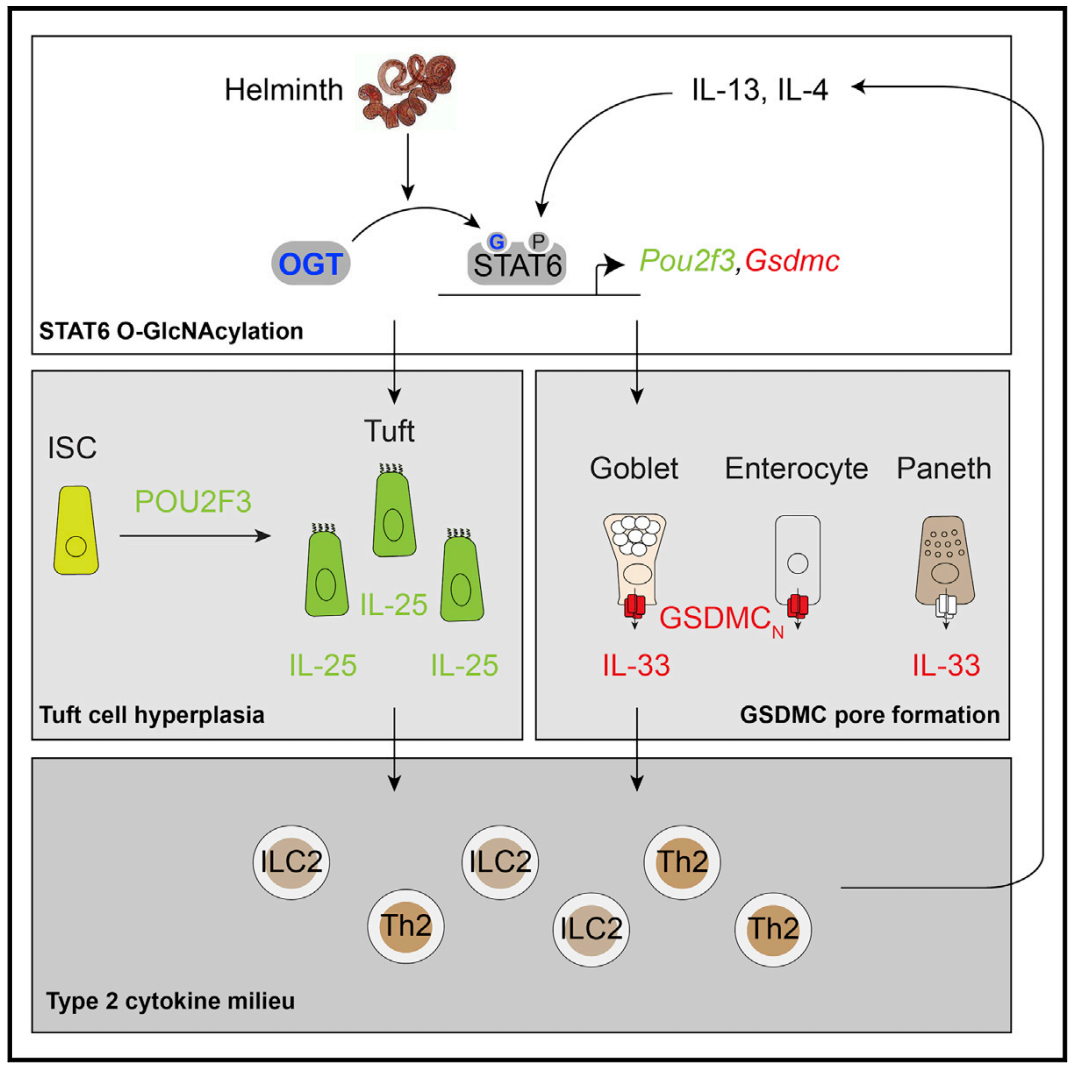
图一. STAT6 糖基化调控小肠上皮细胞抗寄生虫免疫新机制



