2022年4月12日,南京大学医学院模式动物研究所甘振继教授课题组在国际著名学术期刊Journal of Experimental Medicine在线发表了题为“FNIP1 regulates adipocyte browning and systemic glucose homeostasis in mice by shaping intracellular calcium dynamics”的研究成果。此项工作揭示了FNIP1蛋白通过内质网SERCA Ca2+泵调控白色脂肪组织产热重塑的新机制。南京大学博士殷雨敬,博士后徐登球和博士研究生毛岩为本文的共同第一作者,甘振继教授为该篇论文的通讯作者。

代谢疾病已成为我国重大的公共健康问题。肥胖、2型糖尿病、脂肪肝等代谢性疾病目前在我国呈迅猛高发之势,这严重影响国民身体健康和生活质量,造成了沉重的社会负担。脂肪组织是维持机体能量平衡和调节机体生理功能的重要多功能代谢器官。脂肪组织具有极强的可塑性,其重要表现之一即在冷刺激下,储存能量的白色脂肪组织可转变为消耗能量并适应性产热的褐色脂肪组织,这一过程称为“白色脂肪组织产热性重塑”,或称为“褐脂化”。对代谢健康诸多有益的褐脂化为治疗肥胖和代谢疾病提供了巨大的潜力。
甘振继教授课题组前期系列骨骼肌代谢研究揭示了FNIP1蛋白是独立于AMPK/PGC-1a之外调节代谢网络新的关键节点分子,通过对FNIP1蛋白的深入研究有望进一步发现和解析机体代谢调控的新机制。鉴于前期骨骼肌代谢研究也表明了白色脂肪组织产热重塑能挽救骨骼肌线粒体代谢功能的衰减,最终改善机体的代谢平衡,从而在转化医学中具有重要意义。作者进一步探索白色脂肪细胞产热重塑调控的新机制。利用前期摸索、建立的免疫共沉淀及定量质谱体系,结合体外生化细胞研究,作者发现了内质网SERCA Ca2+泵可与FNIP1协同作用:FNIP1与SERCA直接结合并促进其Ca2+泵活性。针对白色脂肪细胞内迄今未知的Ca2+动力学调控与功能研究难题,作者融合了体内/体外Ca2+成像、经典细胞生化、基因敲除小鼠等方法,揭示了FNIP1蛋白通过促进内质网SERCA Ca2+泵活性,削弱胞内Ca2+信号,进而抑制白色脂肪组织产热重塑的新机制。值得一提的是,在小鼠脂肪细胞中解除这一FNIP1抑制作用可显著促进白色脂肪褐脂化,这使得小鼠抵抗高脂饮食导致的脂肪肝并提高机体的胰岛素敏感性。
这项研究揭示了胞内Ca2+信号在白色脂肪细胞产热重塑中的重要作用;拓展了代谢调控新的关键节点分子FNIP1新功能——白色脂肪细胞产热内在“刹车机制”;为通过解除白色脂肪细胞“褐脂化”的限制性因素,充分释放脂肪组织产热潜能的全新思路提供了理论基础。研究工作为探寻防治肥胖和代谢疾病的新途径提供了实验依据。
上述研究得到了国家自然科学基金委、科技部、教育部、江苏省科技厅以及中央高校等基金的支持。
原文链接:https://rupress.org/jem/article-abstract/219/5/e20212491/213128
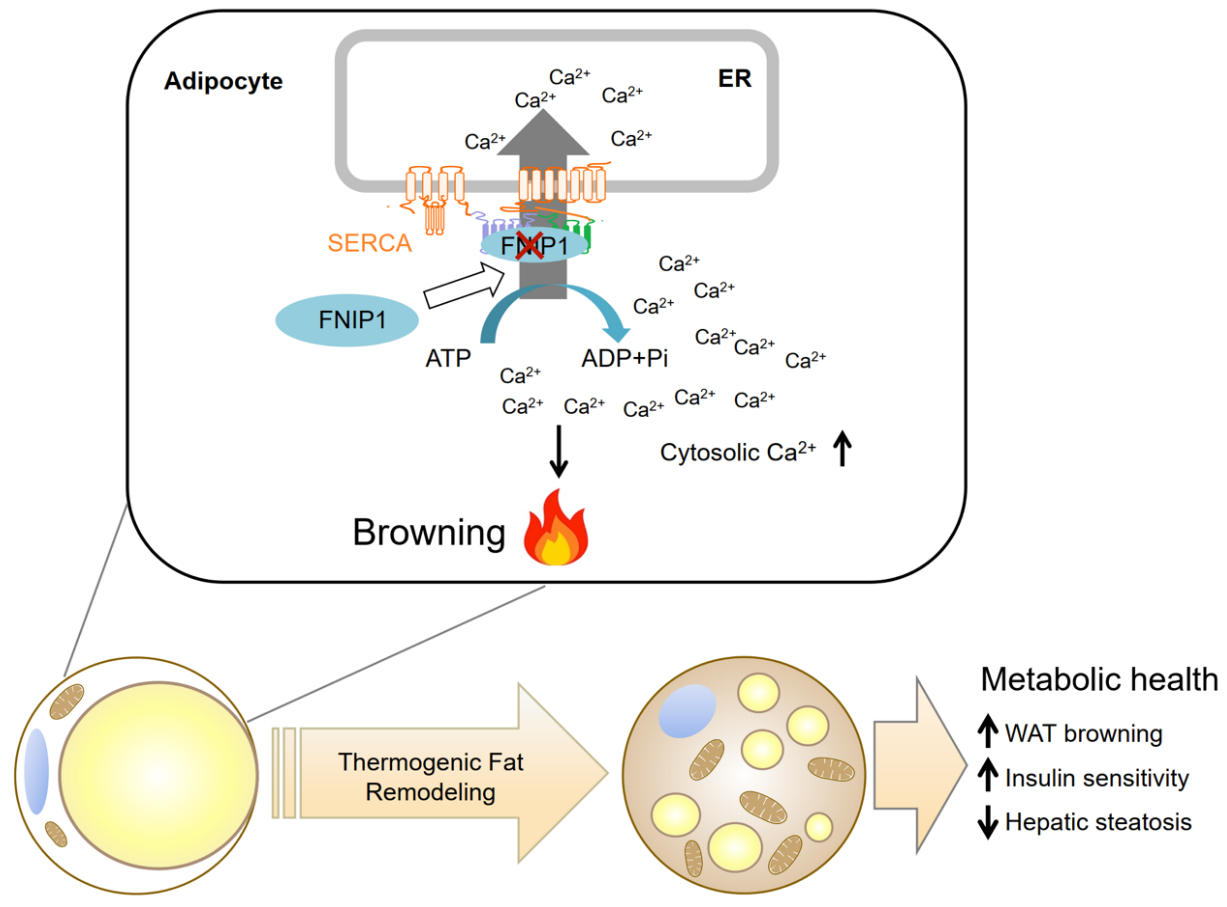
FNIP1/Ca2+通路调控白色脂肪细胞产热重塑新机制



