甘振继教授课题组系统地揭示骨骼肌含量调控新机制
骨骼肌作为人体最大的器官(约占人体重的40%),不但是人类精彩生命运动的基础,还是机体至关重要的能量代谢器官,更是健康体魄的根本保证。骨骼肌具有高度的可塑性,骨骼肌含量随着运动负荷、衰老与疾病状态等因素的变化而改变。肌肉废用如不运动、疾病或衰老可引发肌肉萎缩,导致肌肉进一步衰减恶性循环,从而降低人的生活质量,增加死亡风险。肌肉衰减已经成为当前亟待解决的健康医学问题。近期,医学院模式所甘振继教授课题组系统性地揭示了骨骼肌含量调控的新机制,相关研究成果分别发表在国际著名期刊Nature Communications和Journal of Clinical Investigation上。
2022年2月16日,Nature Communications在线刊发了甘振继教授团队题为“Disuse-associated loss of the protease LONP1 in muscle impairs mitochondrial function and causes reduced skeletal muscle mass and strength”的最新研究成果。南京大学博士研究生徐志圣,付婷婷和郭奇奇为本文的共同第一作者,甘振继教授为通讯作者。此项工作揭示了肌肉废用过程中线粒体蛋白质稳态控制与肌肉含量和功能维持之间的机制关联。

骨骼肌富含线粒体,线粒体对骨骼肌的功能至关重要。因此,骨骼肌线粒体需要精细的、多层次的质量监控系统来保障其功能。线粒体蛋白酶被认为是线粒体质量控制的第一道防线。尽管越来越多的研究提示其在线粒体功能保障中的作用非常关键,但线粒体蛋白质稳态控制对于生理及病理应激的响应及其功能还不甚清楚。作者在人和小鼠肌肉萎缩样本中,对多层次的线粒体质量监控机器进行了系统的考察。研究发现骨骼肌线粒体蛋白酶LONP1特异性的响应肌肉废用信号,在人和小鼠中均与肌肉废用引发的肌肉萎缩密切相关。作者利用多个LONP1缺失的小鼠模型以及体外原代肌肉细胞培养系统展开了详细研究,发现LONP1依赖的线粒体蛋白质稳态控制对肌肉含量和功能维持至关重要。LONP1的缺失会引起线粒体形态异常,功能损伤,蛋白周转减缓,激活自噬-溶酶体降解程序,这导致了肌肉含量减少,力量降低。进一步的机制研究发现,线粒体蛋白酶LONP1的缺失导致其特异性调节底物PARK7蛋白的异常积累,引发肌细胞过度的自噬。此外,为了进一步确证线粒体蛋白质稳态控制与肌肉含量之间的机制关联,作者还构建了另一种转基因小鼠模型,在肌肉中特异性过表达一种线粒体驻留的错误折叠蛋白——突变形式的鸟氨酸转氨甲酰酶(ΔOTC)。该转基因小鼠也展现出与LONP1肌肉缺失小鼠类似的表型。而通过在该小鼠的肌肉中过表达LONP1蛋白酶可恢复线粒体蛋白质稳态、线粒体功能及肌肉含量(图1)。这项研究表明线粒体蛋白酶LONP1是肌肉废用引起的肌肉萎缩的感应器和调节器,为探寻防治肌肉萎缩的新途径提供了实验依据。
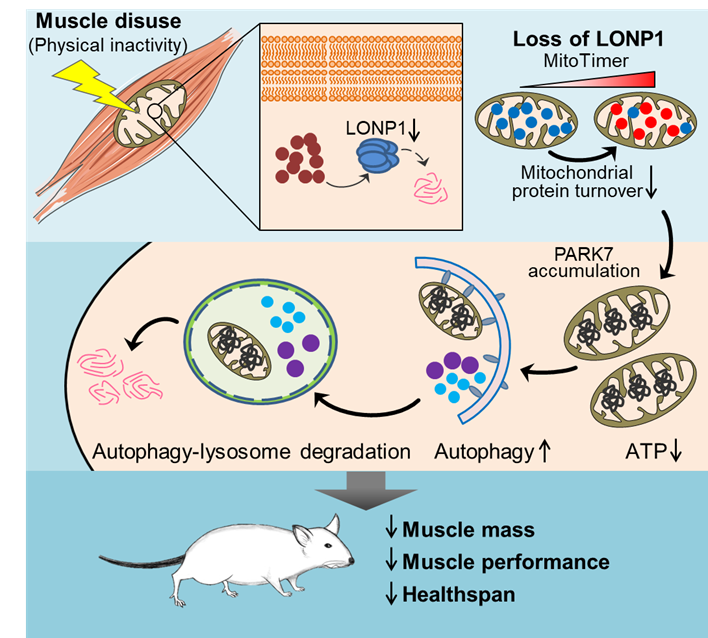
图1. 线粒体蛋白质稳态控制感应肌肉废用介导肌肉萎缩。
此前,2021年9月1日,甘振继教授团队与武汉大学刘勇教授团队合作在Journal of Clinical Investigation上发表了题为“IRE1α regulates skeletal muscle regeneration through Myostatin mRNA decay”的研究成果,甘振继教授为共同通讯作者。此项工作揭示了骨骼肌中内质网未折叠蛋白应激通路调控肌肉生长抑制素(MSTN)mRNA降解影响骨骼肌再生过程,在肌肉损伤修复与肌萎缩疾病的发生发展中发挥重要的功能。

肌肉含量维持除了受肌肉萎缩调控,还与肌肉损伤修复能力息息相关。骨骼肌具有非凡的损伤修复和再生能力,来维持肌肉含量和功能以应对损伤和疾病。肌卫星细胞在肌肉损伤过程中被激活并进行扩增,随后肌细胞分化,肌管再经历肥大生长过程。骨骼肌再生和修复能力随着年龄的增长而下降,并且在许多人肌萎缩疾病中严重受损。文中作者首先在心脏毒素(CTX)诱导的急性肌肉损伤小鼠模型的研究发现,IRE1α在损伤诱导的肌肉再生过程中被激活,而在肌肉特异性的IRE1α敲除小鼠中,心脏毒素诱导的肌肉损伤后再生显著受损。利用肌肉特异性基因敲除/敲降小鼠以及肌细胞培养系统研究发现,骨骼肌再生调控作用依赖于IRE1α抑制其下游的肌肉生长和修复的关键负调节因子MSTN。进一步的分子机制研究发现,IRE1α利用其依赖于RNase的RIDD作用来降解编码肌肉生长抑制素MSTN的mRNA。简言之,在肌肉损伤诱导的再生过程中,肌肉细胞中的IRE1α RNase被激活以降解MSTN mRNA,进而促进成肌细胞的分化和肌管的肥大生长。此外,该研究还发现,这一IRE1α/肌肉生长抑制素调节通路与肌萎缩疾病进展密切相关。在Duchenne肌肉萎缩症(DMD)疾病模型mdx小鼠中,肌肉 IRE1α的缺失导致肌肉生长抑制素信号增强,这导致了肌肉损伤症状的恶化,并且加剧了小鼠不能运动的表型(图2)。这项研究表明IRE1α是骨骼肌再生和肌萎缩疾病进展的重要调节器。研究结果揭示了在肌肉损伤和肌萎缩疾病状况下,内质网应激感应蛋白IRE1α依赖其RIDD活性介导肌肉生长抑制素mRNA 降解,促进骨骼肌损伤再生和修复。鉴于肌肉生长抑制素在肌肉再生和修复方面的公认核心作用,并且已被证明为改善肌萎缩症的重要靶点。通过靶向IRE1α的RIDD输出功能可探寻防治骨骼肌退行性疾病的新途径。

这两项研究系统性地揭示了骨骼肌含量调控的新机制,并提出了“细胞器蛋白质稳态控制决定肌肉含量”的新概念,这些研究工作为防治肌肉衰减疾病提供了新靶点和新途径。上述研究得到了国家自然科学基金委、科技部、教育部、江苏省科技厅以及中央高校等基金的支持,并在相关研究方面得到合作实验室的大力协助与支持。



