2021 年1月20日,南京大学医学院模式动物研究所秦进中课题组在国际学术期刊 《Science Advances》上在线发表题为“Mga safeguards embryonic stem cells from acquiring extraembryonic endoderm fates”的文章,首次揭示在胚胎发育早期,多梳蛋白复合物成员之一,Mga,参与细胞命运决定的分子机制。
哺乳动物早期胚胎发育是一个复杂而有序的生物学过程(见图)。胚胎发育从具有全能性的受精卵开始,伴随着多次卵裂形成桑椹胚。随后,胚胎经历第一次细胞命运决定, 形成由外围的滋养层细胞(trophectoderm,TE)和内细胞团(inner cell mass, ICM)构成的囊胚(blastocyst)。当囊胚由输卵管进入子宫发生着床时,发生第二次细胞命运决定,内细胞团进一步发育分化为具有多能性的上胚层 (epiblast, EPI)和原始内胚层(primitive endoderm, PrE)。囊胚着床之后TE主要分化为胎盘和胎膜等胚外滋养层结构;而上胚层主要会发育形成胚胎的所有组织器官;原始内胚层将发育成内脏内胚层 (visceral endoderm, VE)和脏壁内胚层(parietal endoderm, PE),进而主要形成胚外卵黄囊(extraembryonic yolk sac)。
胚胎干细胞(embryonic stem cells,ESCs)和胚外内胚层干细胞(extraembryonic endoderm stem cells,XEN cells)分别来源于囊胚期内细胞团的EPI和PrE(见图)。ESCs能够无限地自我更新(复制),并具有向胚胎三个胚层来源的所有细胞及组织分化的潜能-全能性。鉴于这些特性,胚胎干细胞已成为研究早期胚胎发育的最佳模型。
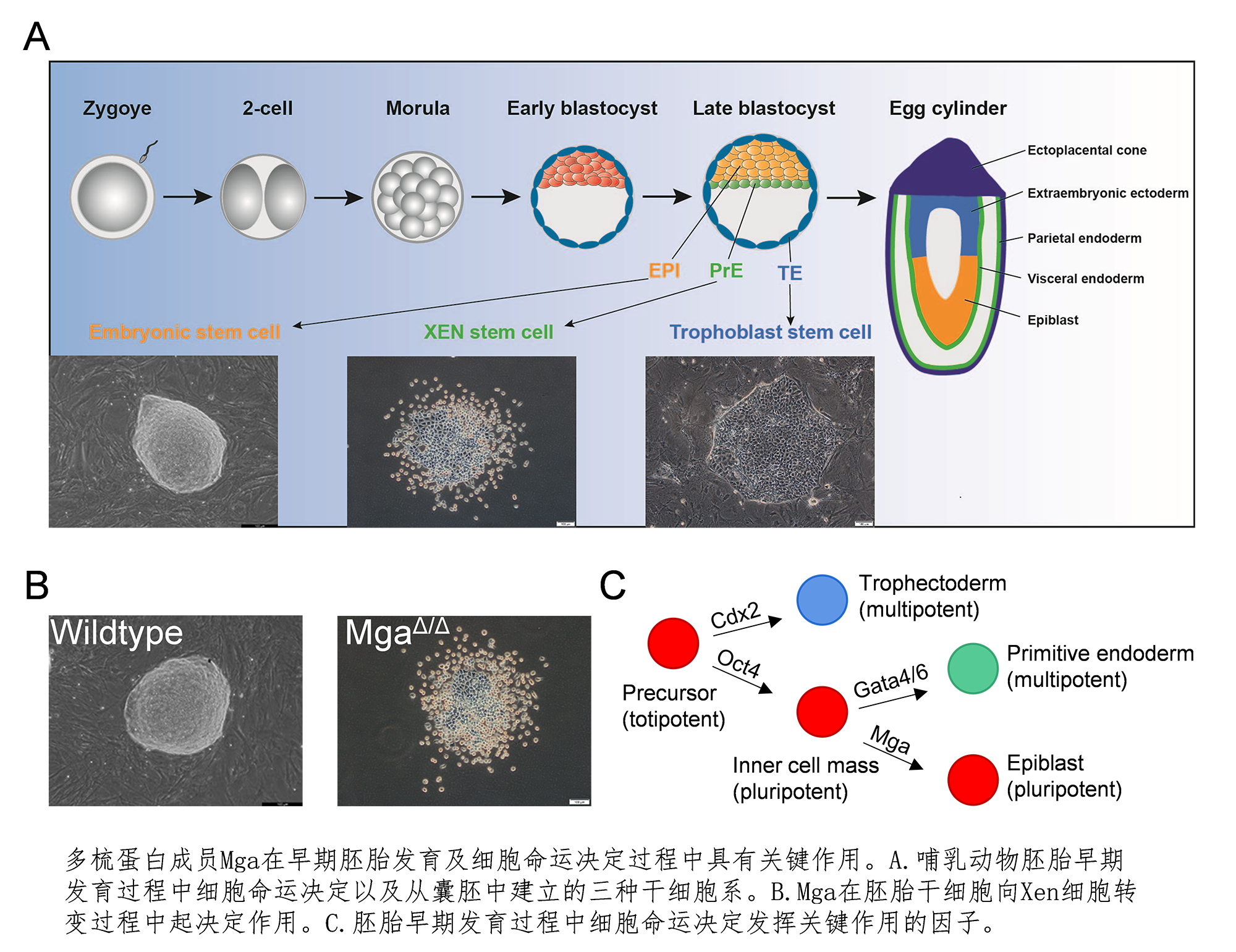
几十年来,人们一直认为Nanog和Gata4/6的相互拮抗决定原始内胚层的形成。 可是,在剔除Nanog基因的胚胎干细胞中,研究人员并没有检测到与原始内胚层相关基因的表达以及细胞形态的改变。在哺乳类动物中,多梳蛋白家族(Polycomb group proteins,简称 PcG)通过组蛋白的甲基化或泛素化修饰致使与分化相关靶基因的表达沉默,从而参与个体生长发育过程中细胞命运的转变。为了揭示PcG在原始内胚层分化中的作用,研究人员利用CRISPR/Cas9基因编辑技术建立PcG的稳定敲除胚胎干细胞株。在对这些细胞株的深入分析过程中,研究人员发现原始内胚层相关基因Gata4/6在剔除PcG家族成员Mga的胚胎干细胞株中高度表达。全转录组测序 (RNA-Seq)结合细胞显微形态分析显示,Mga剔除细胞逐渐由典型胚胎干细胞向胚外内胚层干细胞转变。研究人员进一步分析了Mga在胚胎干细胞中抑制原始内胚层分化的具体分子机制,发现Mga是通过稳定它所在的PcG复合物(PRC1.6)来发挥作用的。另外,研究人员还发现该复合物在胚胎干细胞中主要沉默原始内胚层关键基因Gata4/6及Sox17从而避免向原始内胚层的转变(见图)。与上述发现相吻合的是Mga剔除的小鼠会导致早期胚胎致死。目前正利用条件性Mga剔除小鼠研究胚胎发育早期Mga是如何被调控从而触发原始内胚层的分化。综上,这项系统的研究揭示了胚胎干细胞多能性维持及其向胚外内胚层定向分化的分子机制,加深了我们对胚胎早期细胞命运决定的理解。
南京大学医学院模式动物研究所秦进中博士为本文第一作者及通讯作者。该论文的其他作者还包括秦进中实验室研究生王聪聪、朱亚如、苏婷、董丽霞、黄义凯和郝坤莹。该研究由国家自然科学基金委和江苏省双创人才项目资助,在南京大学医学院模式动物研究所独立完成。
文章链接: https://advances.sciencemag.org/content/advances/7/4/eabe5689.full.pdf



