遗传性耳聋是最常见的残疾健康问题,严重影响人类生存质量,治疗原则宽泛缺乏针对性。由转录因子POU4F3突变引起DFNA15是临床常见的常染色体显性遗传性耳聋,虽然分子诊断率逐渐提高,但其致病机制尚不清楚,亦缺乏针对性的治疗手段。
2020年9月25日,南京大学鼓楼医院耳鼻咽喉头颈外科和南京大学医学院模式动物研究所联合团队在PLOS Genetics上发表了题为Aldh inhibitor restores auditory function in a mouse model of human deafness的重要科研论文。

该研究成功构建了携带人类POU4F3突变的DFNA15精准小鼠模型,检测到该突变小鼠的渐进性听力下降能完全模拟人类DFNA15的听力损失临床表型(图一)。同时,该研究揭示了突变小鼠耳蜗毛细胞缺失,纤毛结构异常、线粒体形态紊乱等DFNA15耳聋的重要病理机制。POU4F3突变所致的DFNA15耳聋表现的渐进性的听功能下降及毛细胞丢失还受到遗传-环境因素互作的影响,其表型的严重程度可能受到遗传背景、噪音暴露、年龄等环境因素的共同作用。这一发现也就解释了人群中DFNA15的听力损失的遗传异质性。此外,该项研究通过 Pou4f3敲除小鼠的构建及表型分析,进一步明确了DFNA15耳聋是由于Pou4f3半剂量不足引起。重要的是,抑制视磺酸信号通路(如乙醛脱氢酶抑制剂、视磺酸受体拮抗剂等)能促进Pou4f3在耳蜗组织的表达从而抑制Pou4f3突变小鼠的听功能减退,从而为DFNA15耳聋的靶向性药物治疗提供了新途径。
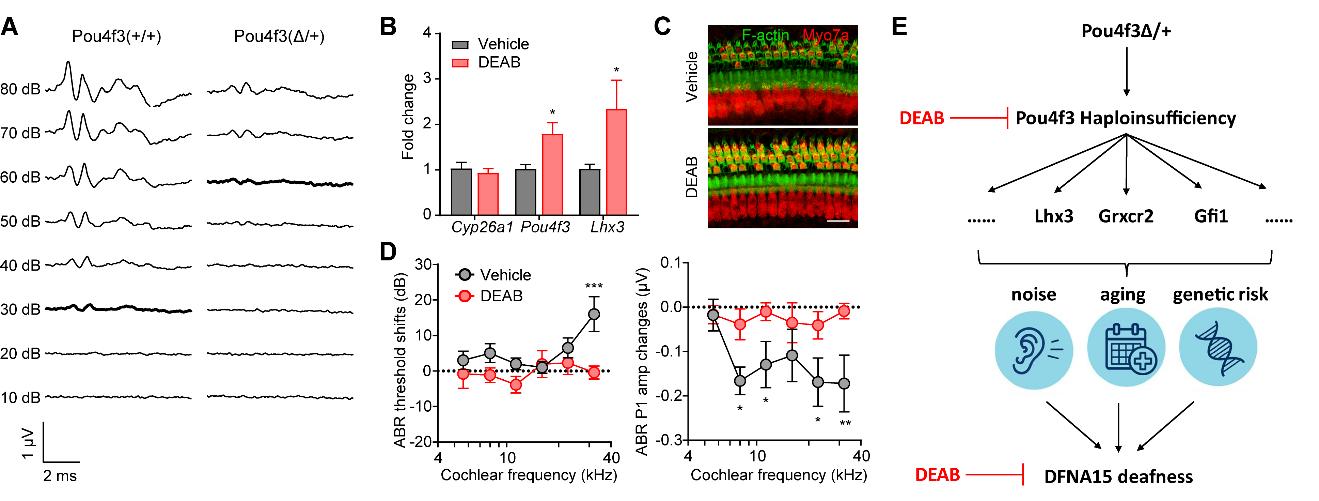
图一、DFNA15遗传性耳聋的致病机制和小分子治疗策略。(A)Pou4f3突变小鼠呈现听力损失;(B-D)乙醛脱氢酶抑制剂DEAB促进Pou4f3表达(B)、减少毛细胞死亡(C)和抑制DFNA15耳聋进程(D);(E)本项目成果示意图(小插图修改自Mayo Clinic)。
综上,通过对Pou4f3基因突变/敲除的动物建模、表型分析、机制研究以及药物测试,本项研究系统性的揭示了DFNA15这一中国人群常见的遗传性耳聋的组织病理学、分子及细胞生物学致病机制和潜在的临床治疗策略。
南京大学朱光洁,龚思皓,马登滨,陶陶以及苏州大学何伟奇为该文的共同第一作者;万国强、高下、朱敏生为该文的共同通讯作者。原文链接:https://doi.org/10.1371/journal.pgen.1009040



