生病打点滴时,为什么要挂以0.9%氯化钠成分为主的生理盐水呢?这是因为人体细胞所处的体液渗透压对应了0.9%的氯化钠,过高或者过低的盐浓度会引起血红细胞的皱缩和膨胀,从而导致红细胞的破裂。
事实上,在长期的进化过程中,生命体已经发展出对抗细胞形变压力的多种机制。比如,植物细胞外面有一层厚厚的以纤维素和果胶为主的细胞壁,细菌也有一层以肽聚糖为主的胞壁,保护它们在遇到大雨时,细胞不会破裂。那么对于柔软的动物细胞来说,在遇到低渗环境怎样维持细胞的形态和大小呢?
过去的研究表明,处于低渗环境时,动物细胞会膨胀,造成细胞膜上的非选择性正离子通道(NSCC)激活,提升细胞内的钙浓度,通过系列生理和生化变化,将细胞内的无机离子和一些有机小分子驱除出去,降低细胞内的渗透压,从而和细胞外的低渗环境保持一致,恢复细胞的大小和形态,这样的过程称为调节性容积减小(RVD)。尽管在数十年前就已经知道细胞膜上存在细胞容积膨胀激活的NSCC,然而这个渗透压感受器到底是什么分子却一直不清楚(1-3)。
2020年5月5日,南京大学模式动物研究所的石云课题组和万国强课题组在Cell Reports 上联合发表了题为The Cation Channel TMEM63B Is An Osmosensor Required for Hearing(正离子通道TMEM63B是听觉必须的渗透压感受器)的重要科研论文。
在这篇论文里,研究者研究了一个功能未知的正离子通道TMEM63B。发现敲除这个基因后,小鼠对声音完全没有反应(耳聋,图1A)。仔细研究发现TMEM63B在小鼠的内耳听毛细胞高度表达。哺乳动物的听毛细胞分布在被称为柯蒂氏器的组织上,为1排内毛细胞和3排外毛细胞(图1B)。小鼠出生后大约14天,耳道打开并开始出现听力反应。研究者发现在TMEM63B敲除小鼠,内耳外毛细胞在小鼠有了听力之后迅速程序性坏死(necroptosis)(图1B,C)。这种细胞死亡方式暗示细胞经历过溶胀过程(4)。研究者于是用低渗溶液处理外毛细胞,发现正常的外毛细胞能够抵抗低渗刺激,维持细胞形态,而TMEM63B敲除的外毛细胞对低渗完全没有抵抗力,迅速膨胀变圆(图1D)。值得注意的是,研究者用了很微弱的低渗刺激,仅仅将渗透压降低了5%(从正常的300mOsm/L降到285mOsm/L),可见外毛细胞对于渗透压变化多么敏感。正常外毛细胞在低渗处理时细胞内钙浓度会上升,而TMEM63B敲除的外毛细胞在低渗时细胞内钙浓度不变(图1E),表明TMEM63B介导了钙内流,引起了RVD。
研究者进一步用细胞系表达TMEM63B和同一家族的TMEM63A和TMEM63C,发现它们都是低渗激活的正离子通道,在低渗处理时,介导钙离子进入细胞,所以它们是科学家长期寻找的渗透压感受性的NSCC。
那么问题来了,TMEM63B在內毛细胞和外毛细胞都高度表达,为什么敲除TMEM63B只有外毛细胞死亡,而內毛细胞却相安无事呢(图1B)?
这和外毛细胞特殊的形态以及生理功能有关。众所周知,人类能够听到的声波频率在几千到几万赫兹,而且能够精准区分不同频率的声波,这是因为耳蜗内有一个称为柯蒂氏器的组织,它能够区分音波的频率,在特定位置引发最大强度的机械震荡(请参考生理教科书上的行波理论)。柯蒂氏器上的外毛细胞是细长的圆柱状上皮细胞,只有顶膜和基底膜附着在相邻的支持细胞上,整个侧面都暴露于淋巴液中。这样的结构使得外毛细胞与柯蒂氏器一起以同样的频率伸缩震荡。柯蒂氏器和其上的外毛细胞的机械震荡对于对哺乳动物听觉敏感度必不可少,这是我们能够欣赏音乐的细胞学基础。然而外毛细胞的高频震荡引起了严峻的变形和溶胀挑战(可以想像成一个弹簧,每秒钟伸缩1万次),研究者认为TMEM63B介导的RVD过程可以缓解这一压力。
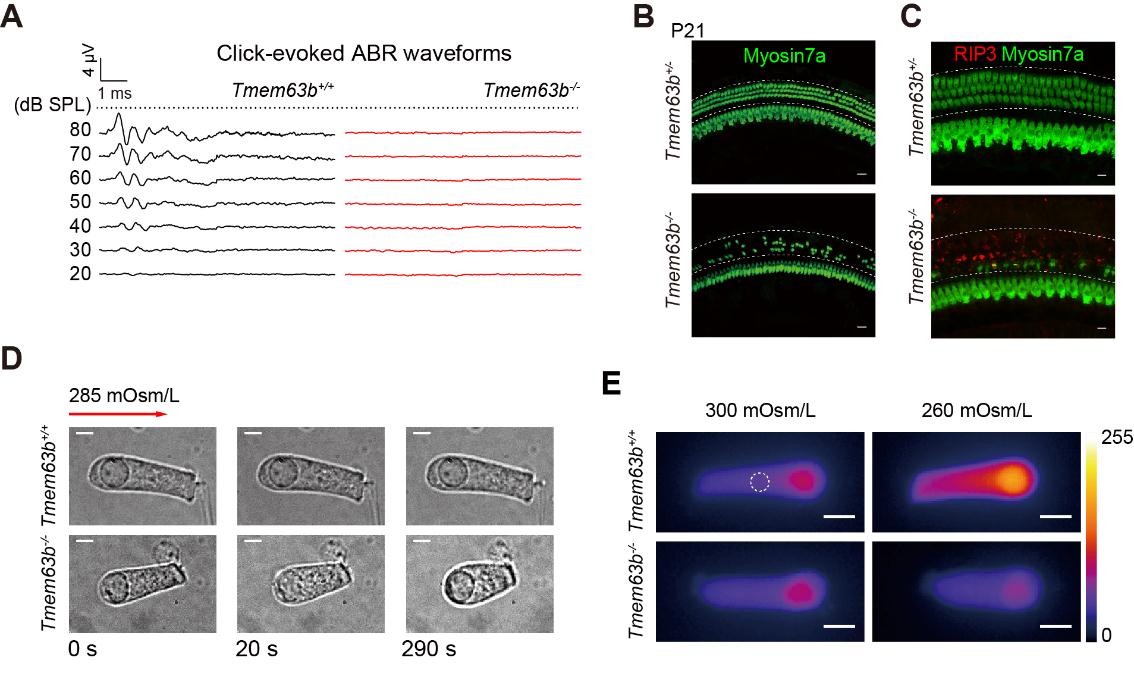
图1. TMEM63B敲除导致小鼠耳聋。A.听力脑干反射(ABR)在TMEM63B敲除的小鼠完全缺失,表明小鼠没有听力。B. 在TMEM63B敲除的小鼠耳蜗,外毛细胞大量丢失。C.这些外毛细胞死于程序性死亡,RIP3信号表明necroptosis细胞死亡途径激活。D.在给与微弱的低渗处理时(从300mOsm/L降到285mOsm/L)时,正常外毛细胞形态维持不变。而TMEM63B敲除的细胞快速膨胀变圆。 E. 正常外毛细胞在低渗处理时,胞内钙信号增强,敲除细胞胞内钙信号不变。
接着新问题来了,既然外毛细胞的震荡频率高达数万赫兹(每次伸缩周期低于0.1毫秒),TMEM63B介导RVD有这么高的时间灵敏度吗?研究者发现TMEM63B主要表达在外毛细胞的基底膜上(图2),这样的表达分布有两个好处:第一、在细胞伸缩震荡时,基底膜有最大的曲张度变化,有利于TMEM63B通道的激活;第二、TMEM63B下游的反应分子--钙激活的钾离子通道也位于基底膜上,空间上的紧密偶联,使得细胞的形变信号能够快速地转化为钾离子的释放,从而快速地维持细胞形态(图2)。这样的发现使人不得不感慨生命体精准的装配机制。
本论文的创新发现在于确认了TMEM63通道家族是细胞容积敏感的非选择性正离子通道,解决了数十年来一直不清楚的一个科学疑题。同时解释了TMEM63B作为渗透压感受器,在听外毛细胞中的保护作用机制。这篇论文也明确地揭示了钙依赖性的RVD对于听毛细胞在正常声音条件下具有不可或缺的保护作用,而这一点在过去完全不知道。本文的发现为噪声性耳聋提出新的治疗靶点。
南京大学博士研究生杜晗,叶畅和吴丹为该文的共同第一作者。万国强副教授和石云教授为该文的共同通讯作者。研究受到科技部重大专项基金,国家自然基金委和教育部中央高校基金的支持。

图2. TMEM63B保护听觉外毛细胞的机制示意图。Tmem63b基因敲除小鼠对声音完全没有反应。它们耳蜗内外毛细胞全部丢失,原因是缺少TMEM63B后,外毛细胞会持续膨胀,形态无法维持。
1. Wehner, F. (2006) Cell volume-regulated cation channels. Contributions to nephrology 152, 25-53
2. McCarty, N. A., and O'Neil, R. G. (1992) Calcium signaling in cell volume regulation. Physiological reviews 72, 1037-1061
3. Christensen, O. (1987) Mediation of cell volume regulation by Ca2+ influx through stretch-activated channels. Nature 330, 66-68
4. Okada, Y., Maeno, E., Shimizu, T., Dezaki, K., Wang, J., and Morishima, S. (2001) Receptor-mediated control of regulatory volume decrease (RVD) and apoptotic volume decrease (AVD). J Physiol 532, 3-16



