骨骼肌约占体重的40%,是体内最大的代谢器官,它在全身糖脂代谢稳态调控中起关键作用。骨骼肌可以储存60-80%左右的餐后葡萄糖,在全身葡萄糖稳态的调控方面有极为重要的作用[1];同时它在全身脂质稳态调控中也扮演关键角色[2]。骨骼肌是胰岛素敏感器官,餐后胰岛素可促进骨骼肌葡萄糖和脂肪酸摄取;骨骼肌胰岛素抵抗导致餐后骨骼肌葡萄糖和脂肪酸摄取能力下降,引发全身糖脂代谢紊乱,最终导致2型糖尿病[3, 4]。然而胰岛素依赖的骨骼肌糖脂代谢调控机理以及骨骼肌胰岛素抵抗的成因目前都不完全清楚。
2019年4月 3日,南京大学模式动物研究所陈帅课题组在Science子刊《Science Advances》上发表题为“Targeting RalGAPα1 in skeletal muscle to simultaneously improve postprandial glucose and lipid control ”的论文[5]。该工作发现了胰岛素信号通路远端分子RalGAPα1是骨骼肌糖脂代谢调控的关键因子,其表达和磷酸化修饰异常是造成骨骼肌胰岛素抵抗的一个重要原因。该分子有望成为2型糖尿病新一代药物研发分子靶点。
胰岛素结合并激活其受体后,可募集并磷酸化胰岛素受体底物蛋白(IRS)的酪氨酸位点,IRS进一步募集并激活下游的磷脂酰肌醇-3激酶(PI-3K)/蛋白激酶B(PKB)信号通路,从而调控骨骼肌糖脂代谢。但PKB如何调控骨骼肌糖脂代谢,这一问题尚有待回答。IRS可以被JNK、PKC以及mTOR等蛋白激酶在丝氨酸位点上磷酸化,这会抑制其酪氨酸磷酸化,从而减弱胰岛素信号通路活性,这是骨骼肌产生胰岛素抵抗的经典机制。然而,除了这一经典机制外,目前并不清楚是否存在其它机制参与骨骼肌胰岛素抵抗的产生。
2014年陈帅课题组在骨骼肌中发现了胰岛素通路的新组分RalGAPα1,胰岛素通过PKB可磷酸化RalGAPα1的Thr735位点,进而诱导其与一类叫做14-3-3的调节蛋白结合[6]。然而RalGAPα1及其磷酸化修饰的在体功能一直未知。RalGAPα1是RalGAP蛋白复合体的催化亚基,它可与β调控亚基形成异源二聚体,进而调控RalA和RalB两个小G蛋白,促进它们由GTP装载形式转变成GDP装载形式[7]。在《Science Advances》发表的研究中,作者通过构建高脂诱导肥胖小鼠模型、RalGAPα1T735A基因敲入以及RalGAPα1骨骼肌特异性敲除小鼠模型深入研究了RalGAPα1生理、病理作用与机制(图一)。作者发现胰岛素−PKB通路磷酸化RalGAPα1-Thr735位点,可抑制后者的活性,进而激活小G蛋白RalA;而活化的RalA会促进葡萄糖转运体GLUT4和脂肪酸转运蛋白CD36从细胞浆向细胞膜转位,从而介导骨骼肌细胞对葡萄糖和脂肪酸的摄取。在RalGAPα1T735A基因敲入小鼠中,胰岛素无法磷酸化RalGAPα1,导致骨骼肌细胞对葡萄糖和脂肪酸的摄取受阻,最终导致突变小鼠出现肥胖、高血糖、高血脂、葡萄糖不耐受和胰岛素抵抗等代谢病症。有意思的是,高脂饲喂会上调骨骼肌中RalGAPα1蛋白水平并抑制其磷酸化,进而抑制下游RalA小G蛋白。当在骨骼肌中特异性敲除RalGAPα1可促进骨骼肌中GLUT4和CD36转位,提高骨骼肌对葡萄糖和脂肪酸的摄取,降低血糖、血脂水平,改善高脂饮食造成的葡萄糖代谢紊乱。作者还研发了一种可靶向RalGAP蛋白复合体的β-阻遏多肽,在骨骼肌细胞中可抑制RalGAP蛋白复合体,提高骨骼肌细胞对葡萄糖和脂肪酸的摄取。
综上,该项研究发现了胰岛素通路远端分子RalGAPα1是骨骼肌糖脂代谢以及胰岛素抵抗发生中的关键因子,为2型糖尿病的药物研发提供新思路和新分子靶点。目前,作者正在β-阻遏多肽进行深入测试与模拟改造,期望将来能成为靶向骨骼肌、治疗代谢疾病的原型药物。
南京大学模式动物研究所副研究员陈俏利博士和博士生荣平、朱桑桑为本文共同第一作者,陈帅教授为本文通讯作者。
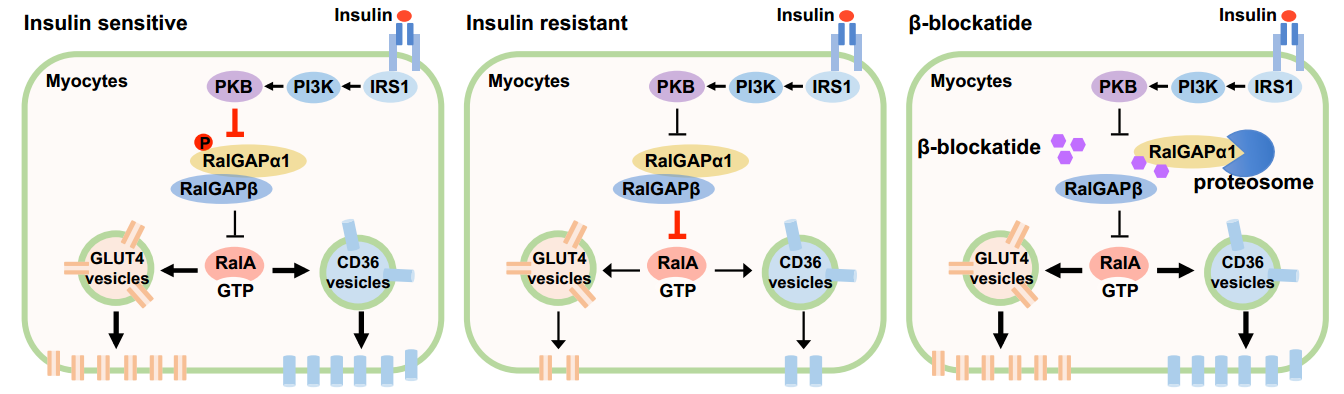
图一 RalGAPα1/β 复合体调控骨骼肌糖脂代谢及骨骼肌胰岛素敏感性(图片引自Science Advances EAAV4116)
1. Katz, L.D., et al., Splanchnic and peripheral disposal of oral glucose in man. Diabetes, 1983. 32(7): 675-9.
2. Chen, Q., et al., Rab8a Deficiency in Skeletal Muscle Causes Hyperlipidemia and Hepatosteatosis by Impairing Muscle Lipid Uptake and Storage. Diabetes, 2017. 66(9): 2387-2399.
3. Chen, S., et al., Mice with AS160/TBC1D4-Thr649Ala knockin mutation are glucose intolerant with reduced insulin sensitivity and altered GLUT4 trafficking. Cell Metab, 2011. 13(1): 68-79.
4. Karlsson, H.K., et al., Insulin signaling and glucose transport in skeletal muscle from first-degree relatives of type 2 diabetic patients. Diabetes, 2006. 55(5): 1283-8.
5. Chen, Q.L., Rong, P., Zhu, S.S., Yang, X.Y., Ouyang, Q., Wang, H.Y., Chen, S., Targeting RalGAPα1 in skeletal muscle to simultaneously improve postprandial glucose and lipid control. Science Advances, 2019. 5(4): eaav4116.
6. Chen, Q., et al., GARNL1, a major RalGAP alpha subunit in skeletal muscle, regulates insulin-stimulated RalA activation and GLUT4 trafficking via interaction with 14-3-3 proteins. Cell Signal, 2014. 26(8): 1636-48.
7. Shirakawa, R., et al., Tuberous sclerosis tumor suppressor complex-like complexes act as GTPase-activating proteins for Ral GTPases. J Biol Chem, 2009. 284(32): 21580-8.



