2018年11月19日,南京大学模式动物研究所、南京大学生物医药国家重点实验室石云课题组在国际著名杂志《Nature Communications》上在线发表题为“Signal peptide represses GluK1 surface and synaptic trafficking through binding to amino-terminal domain”的研究成果,揭示信号肽对于大脑神经细胞之间信号传递功能的调控作用。南京大学博士生段桂芳是该工作的第一作者,南京大学的石云教授和中国科学院昆明动物研究所的盛能印研究员为本文的共同通讯作者,共同作者里还有中国科学技术大学的金腾川博士和UCSF的Roger Nicoll教授等。
人的大脑是由约100亿个神经元(即神经细胞)组成,这些神经元通过突触这种特化细胞间连接结构进行信息交换。突触前神经元通过突触前膜释放神经递质,结合于突触后膜的神经递质受体,引起突触后神经元的电生理变化,从而实现神经信号的跨细胞传递。在大脑内,兴奋性的信号传递主要是由突触前膜释放的谷氨酸(神经递质)结合于突触后膜的谷氨酸受体来实现的。因此,谷氨酸受体在神经细胞内合成,转运并恰当地定位到突触后膜对于大脑正常行驶功能具有重要的意义。
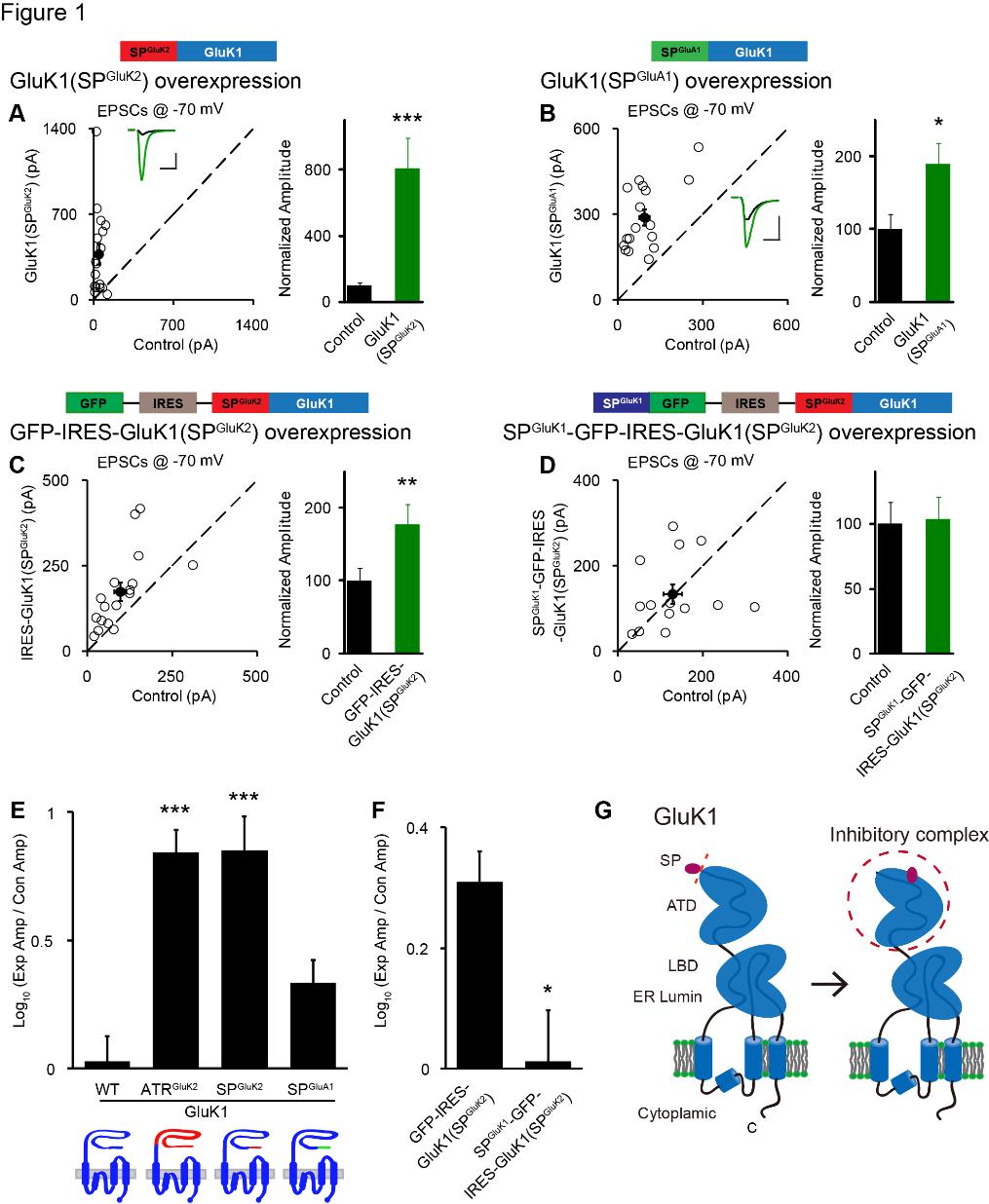
通过与盛能印博士的合作,石云课题组在利用CA1椎体神经元来研究Kainate-型谷氨酸受体(KAR)的突触功能时发现:在CA1神经元表达GluK2受体能够进入突触后膜,极大地(>10倍)增强突触后电流(EPSCs),而表达GluK1受体却不能进入突触后膜,不影响EPSCs ADDIN EN.CITE ADDIN EN.CITE.DATA (Sheng et al., 2015; Sheng et al., 2017)。为了解析KAR受体的突触定位机制,石云课题组依据GluK1和GluK2蛋白结构的相似性,构建和检测了一系列的嵌合型突变受体。他们意外发现GluK1的前导信号肽发挥着关键性调节作用。当GluK1的信号肽替换为GluK2信号肽时,GluK1受体成功定位到突触上,并且该GluK1(SPGluK2)受体能够10倍地增强突触后电流,其幅度与GluK2类似 (Fig.1 A)。课题组人员推测,这个现象存在两种可能的机理,第一、GluK2的“超级”信号肽赋予了GluK1额外的突触转运能力。第二、GluK1信号肽抑制了其本身具有的突触后膜转运能力。为了区分这两种可能性,课题组人员设计了两个实验。第一个实验是将GluK1的信号肽换成GluA1的“弱”信号肽,因为过去的研究表明在CA1神经元表达GluA1时,并不能增强突触活性,结果在这个“弱”信号肽带领下,GluK1(SPGluA1)同样可以增强突触电流 (Fig. 1B, E)。第二个实验更直接,将GluK1的信号肽和GluK1(SPGluK2)共同表达在同一个神经元中,结果GluK1(SPGluK2)的突触增强效应被完全抑制 (Fig. 1C,D,F),说明GluK1的信号肽对于GluK1的突触定位具有反式抑制作用。进一步的解析发现GluK1的信号肽和氨基端结构域(ATD)共同发挥抑制作用,缺一不可。生物化学实验进一步证明GluK1的信号肽可以和GluK1的ATD相互结合。同时,课题组研究人员也发现,信号肽不仅抑制GluK1的突触定位,也抑制了上膜转运。所有这些研究结果表明,GluK1受体的信号肽能够作为一个非常规配体,结合于其ATD结构域,行驶调节GluK1受体胞内转运和突触定位的功能 (Fig. 1G)。
传统的观点认为前导信号肽只是编码新合成蛋白的胞内定位信号,它将新合成的肽链导入内质网,从而最终进入分泌途径或者定位到细胞膜。一般来说,信号肽把肽链导入内质网就完成了其功能,在内质网膜上被信号肽酶切割下来,和后续的转运没有关系。本论文发现了GluK1的信号肽除了指导GluK1进入内质网的经典功能之外,还有调节后续转运的全新功能,这也是膜蛋白的信号肽研究方面的新发现。值得一提的是,本研究是在石云教授参与的一系列研究工作的基础上做出的 ADDIN EN.CITE ADDIN EN.CITE.DATA (Granger et al., 2013; Sheng et al., 2018; Sheng et al., 2015; Sheng et al., 2017)。石云教授的这个成果也和他的团队在2016年的发现 ADDIN EN.CITE ADDIN EN.CITE.DATA (He et al., 2016)遥相呼应。在2016年的论文中,课题组研究人员发现AMPA型谷氨酸受体GluA1/A2的空间排列是由GluA1的信号肽决定的。因此,石云教授的研究表明谷氨酸受体的信号肽在受体的合成和转运中的作用远超其传统功能,而谷氨酸受体的合成和转运也远比预想的要复杂。这些工作揭开了谷氨酸受体胞内复杂合成、装配和转运机制的冰山一角。
石云课题组的研究获得科技部、国家自然基金委、教育部中央高校基金和江苏省科技厅自然基金项目的支持。
ADDIN EN.REFLIST Duan, G.F., Ye, Y., Xu, S., Tao, W., Zhao, S., Jin, T., Nicoll, R.A., Shi, Y.S., and Sheng, N. (2018). Signal peptide represses GluK1 surface and synaptic trafficking through binding to amino-terminal domain. Nature communications 9, 4879.
Granger, A.J., Shi, Y., Lu, W., Cerpas, M., and Nicoll, R.A. (2013). LTP requires a reserve pool of glutamate receptors independent of subunit type. Nature 493, 495-500.
He, X.Y., Li, Y.J., Kalyanaraman, C., Qiu, L.L., Chen, C., Xiao, Q., Liu, W.X., Zhang, W., Yang, J.J., Chen, G., et al. (2016). GluA1 signal peptide determines the spatial assembly of heteromeric AMPA receptors. Proc Natl Acad Sci U S A 113, E5645-5654.
Sheng, N., Bemben, M.A., Diaz-Alonso, J., Tao, W., Shi, Y.S., and Nicoll, R.A. (2018). LTP requires postsynaptic PDZ-domain interactions with glutamate receptor/auxiliary protein complexes. Proc Natl Acad Sci U S A 115, 3948-3953.
Sheng, N., Shi, Y.S., Lomash, R.M., Roche, K.W., and Nicoll, R.A. (2015). Neto auxiliary proteins control both the trafficking and biophysical properties of the kainate receptor GluK1. eLife 4, e11682.
Sheng, N., Shi, Y.S., and Nicoll, R.A. (2017). Amino-terminal domains of kainate receptors determine the differential dependence on Neto auxiliary subunits for trafficking. Proc Natl Acad Sci U S A 114, 1159-1164.



