南京大学医药生物技术国家重点实验室沈萍萍教授课题组在肿瘤免疫调节机制研究中取得重要进展,发现巨噬细胞代谢重编程介导肿瘤免疫反应的新机制。研究成果以“Caspase-1 cleaves PPARg for potentiating the pro-tumor action of TAMs”为题于2017年10月3日在Nature communication上在线发表。论文链接为http://www.nature.com/articles/s41467-017-00523-6。 南京大学博士研究生牛志远、章文龙、束雨新、杨南飞等主要负责该项工作的实验研究,南京大学模式动物研究所/生命科学学院沈萍萍教授为论文通讯作者。
肿瘤形成与进展中,机体会招募巨噬细胞到肿瘤组织并开展系列的免疫杀伤反应。巨噬细胞是机体的一道重要防御屏障,但在这些巨噬细胞中,有一部分细胞在肿瘤微环境的影响下,分化成新的亚群,即肿瘤相关巨噬细胞(Tumor-associated macrophage, TAM)。该类细胞不但不消灭肿瘤,反而促进肿瘤细胞生存、增殖、侵袭和转移,成为猪一样的队友。TAM是如何形成的、如何清除TAM是肿瘤研究领域内的一个非常重要的课题。
课题组研究人员首先在人和动物的肿瘤组织中分离得到一类呈现脂滴积累与高乳酸分泌表型的巨噬细胞。通过功能分析证实该类细胞可显著促进肿瘤的生长,是典型的TAM。研究者发现,这类TAM的形成受caspase-1/PPARγ分子轴的控制。其过程为:肿瘤微环境诱导巨噬细胞caspase-1活化、切割PPARγ分子并产生41 kDa的PPARγ片段,该片段结合线粒体中链脂酰辅酶A脱氢酶(MCAD)并抑制其酶活性。由于MCAD是催化细胞线粒体脂肪酸b氧化起始步骤的关键酶之一,其活性降低直接导致了巨噬细胞内脂肪酸分解代谢偏移及脂滴积累。研究人员证实:正是由于这一代谢特征的改变,导致了巨噬细胞免疫行为的剧烈变化,使其成为肿瘤发展的促进者。根据这一发现,研究人员设计使用了caspase-1小分子抑制剂,结果发现该抑制剂可明显抑制TAM脂滴、MCAD活性,可明显抑制TAM的促肿瘤效应及肿瘤的生长。
该项研究阐明了TAM形成的一种新机制,不但提出了针对免疫细胞代谢重编程而调节肿瘤免疫反应的相关分子基础,同时也为肿瘤临床治疗提供了新思路。该项目得到国家自然科学基金项目、创新团队项目及科技部科技研发项目的资助。
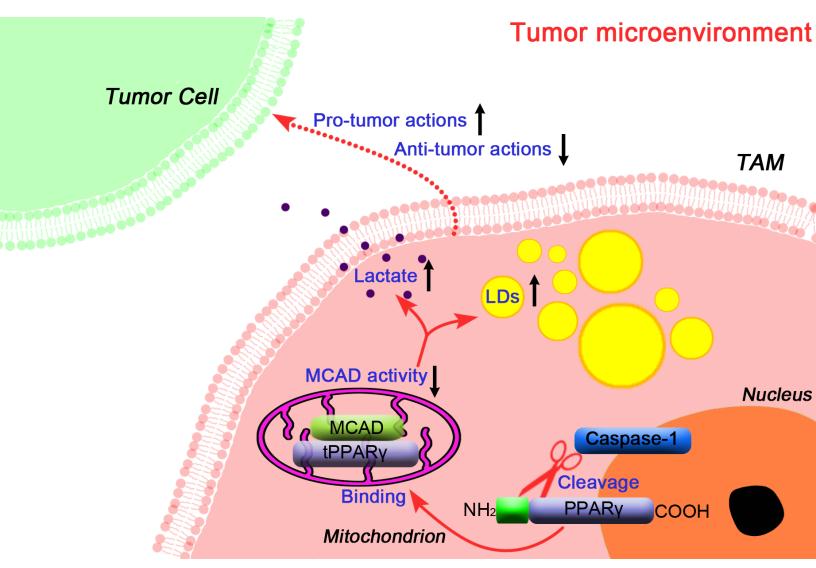
机制示意图



