南京大学模式动物研究所高翔课题组在建立基因敲除的犬类动物模型取得重要进展。南京大学模式动物研究所联合中国科学院广州生物医药与健康研究院、广州医药研究总院等科研单位共同建立了犬类基因打靶技术,培育了世界上首例基因敲除的犬类动物模型。其研究成果《Generation of gene-target dogs using CRISPR/Cas9 system》(利用CRISPR/Cas9建立基因敲除犬)于10月12 日在线发表在《Journal of Molecular Cell Biology》(分子细胞生物学杂志)。南京大学模式动物研究所高翔教授、广州生物院研究员赖良学、和广州医药研究总院主任药师应军为该论文的共同通讯作者。
近年来随着技术发展,牛、羊、猪、猴等大型哺乳动物实现了基因敲除。但母犬卵巢释放的卵母细胞在输卵管内成熟时间长,需要48-72小时才能成熟并具有受精功能。这一生理特征使得体外基因打靶胚胎与受体雌犬很难处于相同的生殖生理周期,导致妊娠失败率增高,犬类基因打靶技术一直未能成功建立。
为了解决这一问题,研究团队建立自体移植策略,即将一侧输卵管内的受精胚胎冲出,进行基因打靶,并马上输回另一侧输卵管,从而克服了供体胚胎与受体雌犬的生殖周期不同步的难题,大幅提高妊娠率,从而成功建立了犬类基因打靶技术。最后在移植的65个胚胎中有27个出生,其中两只为成功剔除了两个等位基因的基因敲除犬。研究组将两只狗分别命名为“大力神”和“天狗”。

图一:世界首例基因敲除犬类模型,左为“大力神”,右为“天狗”
研究团队选取了肌肉生长抑制素基因(myostatin)作为第一个敲除目标基因。该基因在犬类中的自发突变曾被Neuromuscular Disorders 报道过。该基因功能为抑制骨骼肌生长,其被敲除后,肌肉生长发育能力增强,基因敲除犬成年以后将具有更强的运动能力。
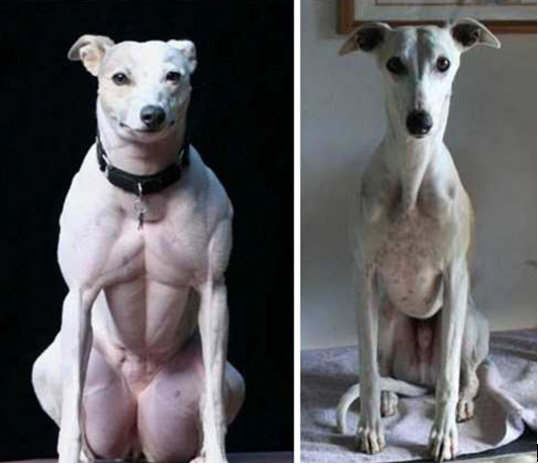
图二: Myostatin天然突变(左)与正常(右)小灵犬对比



